TÁMOP-4.1.2.E-13/1/KONV-2013-0012
"Sporttudományi képzés fejlesztése
a Dunántúlon"
- -> Tananyagfejlesztés
- -> A vázizom...
- -> 6.
6.
6. A VÁZIZOM ALKALMAZKODÓ-KÉPESSÉGE
- 6.1. Akut változások erőedzés hatására
- 6.2. Krónikus változások erőedzés hatására
- 6.3. Az öregedés hatása
A szervezetet érő szokatlan ingerek a szervezet módosított működését váltják ki. Az ingerek erőssége, időtartama, vagy gyakorisága határozza meg azt, hogy érintett szerv milyen mértékben alkalmazkodik. A szokatlan ingerekre bekövetkező változásokat az emberi szervezteben alkalmazkodásnak, adaptációnak nevezzük. A vázizom alkalmazkodó képessége rendkívül sokrétű. Amennyiben a neuromuszkuláris rendszert rendszeres edzésingerek érik, vagyis fizikai aktivitást végzünk, azok fáradással, regenerációval, majd hosszútávú alkalmazkodással fognak válaszolni. Ahhoz, hogy tartós erőnövekedés következzen be, a neuromuszkuláris rendszert az addiginál erősebb ingerek kell, hogy érjék. Alacsony intenzitású ingerek esetén az adaptáció elmarad, vagy akár csökknehet is erőkifejtő képességünk. Szokatlan ingerek tartós hiányában (fizikai inaktivitás, immobilizáció) a neuromuszkuláris rendszer csökkentett működési kapacitással fog rendelkezni. Az izom és az azt mozgató idegrendszer akut és hosszútávú alkalmazkodó képességéről szól ez a fejezet.
6.1. Akut változások erőedzés hatására
6.1.1. Fáradás
Bármely fizikai aktivitás hosszantartó végzésekor fáradást tapasztalunk, melynek oka és tünete eltérő lehet. Valamennyien tisztában vagyunk azzal, hogy nagyobb erőkifejtéskor hamarabb, kisebb erőkifejtéskor viszont később következik be a fáradás. A fáradás fizikai aktivitás hatására bekövetkező csökkenés az erőkifejtő képességben. Az erő csökkenése a teljes neuromuszkuláris rendszer valamely szakaszán (központi idegrendszer, perifériás idegek, izom) bekövetkező élettani változások/módosulások eredménye. Felhívjuk a figyelmet azonban, hogy az erőkifejtő képesség szorosan összefügg az aktuális érzelmi/pszichikai állapottal, így a fáradás nem kizárólagosan akut élettani változásoknak köszönhető. Élettani szempontból a fáradásnak két típusa ismert, a centrális és perifériás fáradás.
Centrális (központi) fáradás (central fatigue) alatt a motoros agykéreg akaratlagos működtetésében bekövetkező elégtelenséget értjük (Taylor és Gandevia, 2008). Centrális fáradáskor a motoros agykéreg és a neuromuszkuláris szinapszis közötti szakaszon következnek be élettani módosulások. Tehát az idegrendszer csökkent működése, elsősorban ingerületvezetési problémák miatt következik be az erővesztés. Az agykéregből kiinduló neurális drive romlik, az akaratlagos erőkifejtés csökken, az ingerületvezetés sebessége csökken. Az izmot kisebb sűrűségű és erősségű akciós potenciálok érik. Az okok az alábbiak lehetnek:
- Az akaratlagos erőkifejtés központjának, a motoros agykéregnek a csökkent ingerelhetősége.
- Az ingerületvezetéshez szükséges elektrolitok koncentrációjának csökkenése.
- Az idegsejtek közötti szinapszisban a mediátor/ingerületátvivő anyagok koncentrációjának csökkenése.
- Oxigénhiányos állapot.
- Vércukorszint csökkenése.
A centrális fáradás vizsgálatában két közismert módszert alkalmaznak. Az egyik ilyen módszer az elektrostimulációs technika (twitch interpolation technique). Ennél a módszernél a vizsgált izommal teljes erejű akaratlagos kontrakciót végez a vizsgált személy, és az erőkifejtés mértékét dinamométerrel, vagy valamilyen egyéb erőmérő berendezéssel mérjük (6.1. ábra). Az erőkifejtés csúcsán az izom motoros idegét egy bizonyos áramerősséggel közvetlenül stimuláljuk, és megfigyeljük, hogy a stimuláció hatására növekszik-e az erőkifejtés. Amennyiben növekedést tapasztalunk, az arra utal, hogy a központi idegrendszer jelent akadályt az erőkifejtésben, hiszen az akaratlagoson túl külső stimulációval még fokozható az erőkifejtés (6.2. ábra). Ha edzés hatására a stimulációs erőkifejtés és az akaratlagos erőkifejtés különbsége nő, centrális fáradás követezett be.
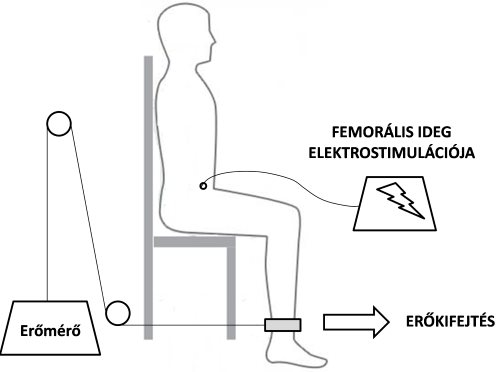
6.1. ábra. A quadriceps femoris izom idegének elektrostimulációja maximális akaratlagos erőkifejtés közben a centrális fáradás mértékének meghatározására.
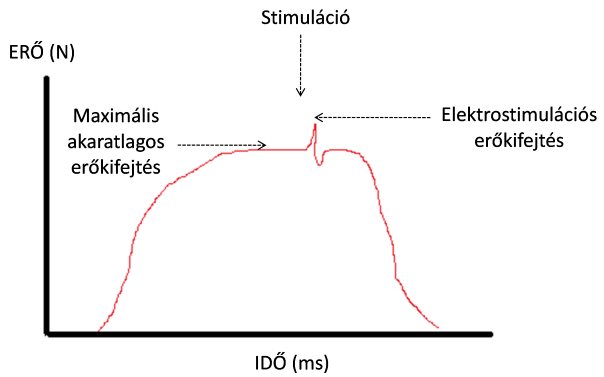
6.2. ábra. A quadriceps femoris által kifejtett erő görbéje az idő függvényében. A vizsgált személy maximális akaratlagos erőt fejt ki, majd az erőkifejtés csúcsának elérésekor a femorális ideg stimulációjával az erőkifejtés még tovább növelhető. Minél nagyobb a két érték különbsége, annál erősebb a centrális fáradás.
Az elektrostimulációs technika hátránya az, hogy csak közvetve utal a centrális paraméterek módosulására, valamint az, hogy az akaratlagos erőkifejtés maximuma csak rendkívül motivált állapotban érhető el. Az 1980-as években fejlesztették ki az agykérgi mágneses stimuláció (transcranial magnetic stimulation, TMS) eljárást (Barker és mtsai, 1985), amellyel közvetlenül vizsgálhatók a corticospinális szakaszon bekövetkező változások. Az eszköz fájdalommentesen alkalmazható, ugyanis nem elektromos árammal, hanem mágneses mezővel ingerli a motoros agykéreg sejtjeit. Az idegsejtekben létrejövő mesterséges ingerület ezután a gerincvelőn és a perifériás idegen keresztül a célizom felé halad, ahol az elektrostimulációs technikához hasonlóan EMG-vel rögzítjük a jelet (6.3. ábra). Az adott izomhoz tartozó agykérgi motoros mező (motor area) megkeresése manuálisan történik. A mágneses impulzus kiváltásával az izom felületére helyezett EMG elektródákkal motoros potenciált (motor evoked potential) mérünk. A motoros potenciál amplitudójának csökkenése, az ingerületvezetési sebesség csökkenése, valamint az agykéreg motoros ingerelhetőségének csökkenése centrális fáradásra utal. Agykérgi motoros mező ingerelhetősége (motor threshold) alatt azt a legkisebb intenzitású mágneses impulzust értjük, amely már ingerületet vált ki az agykéregben.
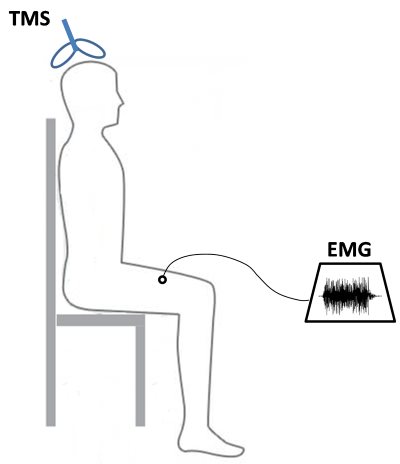
6.3. ábra. Agykérgi mágneses stimuláció (TMS) a centrális fáradás vizsgálatára. Az agykéreg quadriceps femoris izomhoz tartozó motoros mezejének mágneses ingerlése akciós potenciált vált ki a motoros idegben. Az ingerület a gerincvelőn és a perifériás idegen keresztül jut el a quadricepshez, ahol EMG készülékkel detektáljuk annak megjelenését.
Perifériás fáradásnak (peripheral fatigue), vagy izomfáradásnak nevezzük az izom erőkifejtésében bekövetkező csökkenést, melyet a neuromuszkuláris szinapszis utáni szakaszon, vagyis a vázizomban történő élettani módosulások okoznak. A perifériás fáradás következtében az ingerlés-kontrakció folyamata romlik. Ennek számos oka lehet. Nagy intenzitású fizikai aktivitás esetén az energiaraktárak (ATP, glikogén) gyorsan kimerülnek és fokozódik a tejsavtermelés is. A pH csökkenése miatt nagyobb lesz a kontrakció kalciumigénye is, amely egyébként is kisebb mennyiségben áramlik ki a szarkoplazmatikus retikulumból. A kalcium troponinhoz való kötése is jelentősen gátolt. Mindez együttesen kevesebb kereszthíd létesülését és az erőkifejtés csökkenését eredményezi. Végül az izom mikrosérülései is hozzájárulnak az erőcsökkenéshez. A mikrosérülést szenvedett miofibrillumok ugyanis ideiglenesen kikapcsolnak, nem vesznek részt az izomműködésben, és ez az állapot akár napokig is eltarthat.
A perifériás fáradást a fentiekben említett elektrosimulációval vizsgáljuk, itt azonban az izmot nyugalomban stimuláljuk. Az eljárás során a nyugalomban stimulált izomban bekövetkező izomrángás erejét (twitch force) mérjük. Amennyiben az izomrángás ereje csökken, perifériás fáradás következett be (Taylor és Gandevia, 2008).
A centrális és perifériás fáradás kölcsönhatásban áll egymással. Perifériás fáradás miatt például a központi „drive” is hanyatlik. A kétféle fáradás általában együtt következik be, de különböző típusú edzések után ezek súly eltréhet.
6.1.2. Mikrosérülések és regeneráció
Az edzés, különösen az erőedzés után az izmokban fellépő izommerevség, izomfájdalom (izomláz) biomechanikai és élettani okainak feltárására intenzív kutatások folytak. Annak érdekében, hogy bizonyos nagyságú erőnövekedést érjünk el, valamilyen mértékben túl kell terhelnünk izomzatunkat. Élettani szempontból, ahhoz, hogy edzésadaptációt, erőnövekedést hozzunk létre, az izomzatot olyan ingereknek kell érni, melyek meghaladják annak aktuális kondicionális állapotát. Ez a bizonyos „túlterhelés” igen gyakran izomfájdalommal jár. De vajon mi okozhatja ezt a fájdalmat? Miért nem közvetlenül az edzés után jelentkezik, hanem néhány órával, vagy akár napokkal később? Az edzés által okozott izomfájdalom kialakulásának mechanizmusát kívánjuk értelmezni ebben az alfejezetben. Előtte azonban definiálnunk kell a különböző izomfájdalom típusokat, mivel ezek kialakulásának az oka eltérő. Az izomfájdalmakat Safran és mtsai (1989) alapján az alábbiak szerint tipizáljuk:
I-es típusú izomfájdalom, hétköznapi szóval izomláz (delayed onset muscle soreness): szokatlan izommunka következtében kialakuló mikrosérülések hatására fellépő izomfájdalom, diszkomfort érzés, amely nem közvetlenül az izommunka után, hanem azt követően 24-48 órán belül alakul ki. Erre utal az angol „delayed” kifejezés is. A fájdalom mozgás közben, vagy mechanikai nyomás alatt érzékelhető.
II-es típusú izomfájdalom: az izomban valamilyen sérülés, trauma hatására (izom, vagy fascia részleges, vagy teljes szakadása) bekövetkező fájdalom, amely érzékelhető nyugalomban, mozgás közben, vagy mechanikai nyomásra.
III-as típusú izomfájdalom: izommunka alatt, vagy közvetlenül azt követően fellépő görcsszerű, fáradásból adódó fájdalom. Ez elsősorban a fáradással együtt járó kellemetlen érzés.
Ebben a tankönyvben csak az I-es típusú izomfájdalommal foglalkozunk, amely az izomlázat okozza. Az izomláz általában szokatlan fizikai aktivitás után alakul ki, vagy akkor, ha a már megszokott mozgásformákban emeljük az intenzitást. A hétköznapi életben, sportolástól függetlenül is kialakulhat izomláz: ha valaki valamilyen szokatlanul megerőltető feladatot hajt végre, például nehéz terhek megemelése. Szokatlan munka után 6-10 órával az izomban a diszkomfort érzés megjelenik, és a fájdalom megközelítőleg 24-48 óra elteltével tetőzik (Nosaka és Clarkson, 1996). Az izom érzékenységének a mértéke változó lehet, enyhébb esetben kisebb izommerevséget észlelünk, amely a mindennapi általános aktivitásunk alatt viszonylag hamar, 2-3 napon belül megszűnik. Súlyosabb esetben erőteljes fájdalmat érzünk, amely jelentősen gátolhatja mozdulatainkat, és csökkentheti erőkifejtő képességet (Clarkson és mtsai 1992). Az izom disztális régiójában erősebb fájdalmat tapasztalhatunk (Seger és mtsai 1998), egyrészt azért, mert ezen az izom-ín átmeneti részen koncentráltak a fájdalomérző receptorok, másrészt az izom-ín átmeneti részen az izomrostok átlósan helyezkednek el, és erős nyíró erő esetén ki vannak téve a mikroszkopikus szintű sérülések lehetőségének. A legerősebb izomfájdalom is 5-7 napon belül teljesen megszűnik (Muramaya és mtsai 2000).
Számos elmélet létezik az izomláz kialakulásának mechanizmusára, ezek közül is az egyik legismertebb a „tejsav elmélet” (lásd összefoglaló: Armstrong, 1984). Ma már elfogadott tény, hogy a tejsav termelődése egyáltalán nem felelős az izomláz kialakulásáért, ugyanis néhány maximális erejű kontrakció, vagy akár egy hosszantartó stretching is erős izomlázat okozhat, holott intenzív tejsavtermelésnek nyoma sincs. Az izomláz kialakulásának legelfogadottabb elmélete az úgynevezett „mikrosérülés elmélet” (muscle damage theory). Érdekes, hogy ezt az elméletet már több mint száz éve felvetették (Hough, 1902), ám közvetlenül csak néhány évtizede bizonyították. E szerint az elmélet szerint az izom túlzott feszülésekor az izom szarkomer komponensei sérülnek, különösen a Z vonal. Mikroszkopikus felvételeken világosan látható a Z vonal kiszélesedése, vagy szerkezetének teljes felbomlása (Fridén és Lieber 1992), súlyosabb esetben a teljes szarkomer szerkezetének elváltozása. Az ilyen jellegű elváltozásokat nevezzük mikroszakadásoknak, vagy mikrosérüléseknek (microinjury). A mikroszakadások gyulladási folyamatokat indítanak be és ezt a gyulladást érzékeljük fájdalomként. Gyakori, hogy nemcsak a szarkomer, hanem az izomrost membránja, vagy akár a T-tubulusa sérül. A mikrosérülések tehát az izom mechanikai feszüléséből származó mikroszkópikus elváltozások.
A mikrosérüléseket közvetlenül egyetlen módon lehet vizsgálni. Az izomból vett biopsziából metszetet készítünk, amelyet elektronmikroszkóp alatt vizsgálhatunk (6.4. ábra). A metszeteken hisztokémiai eljárásokkal (festéssel) elkülöníthetjük a sérült és ép részeket, és ezeket megszámoljuk. Az egységnyi izomterületre eső sérülések számát vesszük figyelembe. A szarkomer szerkezetében elektronmikroszkóppal vizsgálható elváltozásokat a mikrosérülések közvetlen mutatóinak (direkt markereinek) nevezzük.

6.4. ábra. Vastus lateralis izomból kivett biopsziában a szarkomer Z vonalainak módosulása 90 maximális excentrikus kontrakció után 24 órával (Váczi és mtsai, 2003).
Azokat a mikrosérülés mutatókat, melyekkel nem közvetlenül a szarkomer szerkezeti elváltozását, hanem az azzal együtt járó mechanikai, élettani és biokémiai következményeket mérjük, közvetett mutatóknak (indirekt markerek) nevezzük. Az alábbiakban felsoroljuk a mikrosérülések leggyakrabban vizsgált indirekt markereit:
- Szarkomer fehérjék megjelenése a vérben. A sérült szarkomerekben egyes szerkezeti fehérjék leszakadnak és kiáramlanak a vérkeringésbe. Ilyen fehérjék például a kreatin kináz (CK), a mioglobin, vagy az aktin. A CK az egyik leggyakrabban mért mikrosérülés marker. Sportolóknál rendszeresen mérik a CK értéket. Megerőltető fizikai aktivitás után (pl. maratoni futás) a CK a normál érték akár 400-szorosára is emelkedhet.
- Maximális erőkifejtő képesség csökkenése (Nosaka és Sakamoto 2001). Maximális erőkifejtéskor a lehető legnagyobb számú miofibrillum bekapcsolódik az erőkifejtésbe. A mikrosérülést szenvedett miofibrillumok azonban ideiglenesen kikapcsolnak, így az erőkifejtés jelentősen csökken.
- Az izom duzzadása, az izom keresztmetszetének növekedése. Excentrikus edzés hatására az izomsejtek infiltrációja növekszik, és néhány napon belül helyi ödéma alakulhat ki (Muramaya és mtsai 2000). Ezt általában az érintett végtag kerületének mérésével, vagy akár mágneses rezonancia képalkotással (MRI) vizsgálják.
- Ízületi mozgásterjedelem csökkenése. Az izom duzzadása következtében csökkenhet az ízületi mozgásterjedelem, amely gátolja a mozgást (Nosaka és Sakamoto 2001)
- Izomfájdalom, izomláz kialakulása. A fájdalom gyakori kísérője a mikrosérüléseknek, de csak 24-48 órával edzés után tetőzik (Brenner és mtsai 1999). Az izomláz gyenge összefüggést mutat a mikrosérülések más mutatóival, mint például a maximális akaratlagos erőkifejtéssel, az izom duzzadásának mértékével és az ízületi mozgásterjedelem változásával, így nem tartozik a legmegbízhatóbb mutatók közé (Warren és mtsai 1999).
- Propriocepció csökkensése. Saxton és mtsai (1995) könyökhajlítón végezett excentrikus kontrakció után megfigyelte, hogy jelentősen csökkent a proprioceptív érzékelés a könyökízületben, valamint azt, hogy a vizsgálati személyek felülbecsülték saját erőkifejtő képességüket.
Fontos megjegyeznünk, hogy a fentiekben említett direkt és indirekt mutatók közül önmagában egyik sem nevezhető megbízhatónak. A biopsziavétel során sokszor maga a mintavétel is okoz mikrosérülést. Ráadásul egy rizsszemnyi izomminta nem biztos, hogy reprezentálja a teljes izomban megjelenő sérüléseket. Az indirekt mutatók sem mindig függnek össze egymással. Gyakran előfordul például, hogy az izomláz jelen van, de a vizsgált személy nem veszített erejéből. Több mutató együttes vizsgálata és az eredmények együttes értelmezése vezethet arra, hogy a mikrosérülések mennyiségét megbecsülhessük.
A mikrosérülések kialakulásának mértékét számos tényező befolyásolja. Az alábbiakban ezeket a tényezőket soroljuk fel:
- Az edzés jellege. Brenner és mtsai (1999) megállapították, hogy az erőedzés nagyobb változást okozott a mikrosérülés markerekben, mint az aerob, vagy az anaerob jellegű kerékpáredzés. Az alapelmélet szerint ez logikus, hiszen a mikrosérüléseket elsősorban a nagy izomfeszülés okozza, amelyet elsősorban erőedzés során lehet elérni.
- A kontrakció típusa. Clarkson és mtsai (1986) összehasonlították az excentrikus, a koncentrikus és az izometriás edzés hatását és azt tapasztalták, hogy az excentrikus edzés okozta a legtöbb mikrosérülést. Ezt követte az izometriás edzés, végül a koncentrikus edzés. Megerősíthető tehát, hogy az a kontrakciótípus, amelyben a legnagyobb izomfeszülés érhető el (lásd: erő-sebesség görbe), az okozza a legtöbb mikrosérülést.
- A kontrakció alatt kifejtett erő nagysága. Nagyobb erőkifejtés nagyobb feszülést eredményez az izomban, így a mikrosérülések gyakorisága is nagyobb lesz.
- Az aktuális izomhossz, vagy ízületi szöghelyzet. A nyugalmi hossznál nagyobb izomhosszakon alkalmazott terhelés a mikrosérülések előfordulásának valószínűségét megnöveli. Nosaka és mtsai (2001) vizsgálatában a vizsgálati személyek a könyök flexorokkal excentrikus edzés végeztek. Az egyik kar 50-130 fokos szögtartományban, a másik pedig kar 100-180 fokos szögtartományban mozgott. A második kondícióban nagyobb volt a mikrosérülés markerek változása, mint az elsőben. Ez azzal magyarázható, hogy nyújtottabb helyzetben az izom rövidebb szarkomerei túlnyújtott állapotban terhelődnek, ami miatt több sérülés keletkezik.
- A mozgás terjedelme. Nagyobb mozgásterjedelemben végzett edzés több mikorsérülést okozhat. Amikor a quadriceps izmot 120 illetve 60 fokos mozgástartományban edzették, az előbbinél 39%-os, az utóbbinál pedig csak 12%-os erődeficit keletkezett 24 órával az edzést követően (Váczi és mtsai 2011, Costa és mtsai 2007).
- A kontrakció sebessége. Chapman és mtsai (2006) megállapították, hogy nagyobb sebességgel végzett excentrikus kontrakciók nagyobb mennyiségben okoznak mikrosérülést, mint kisebb sebességnél.
- Az izom feszülésének időtartama. Bár mikrosérülések elsősorban erőedzés hatására alakulnak ki, amennyiben kis erőkifejtési helyzetek sokszor ismétlődnek, a mikrosérülések száma magas lehet. Maratoni futás után pl. nagyon magas CK koncentrációt mértek, melyet a futóciklus excentrikus fázisának több ezerszeri ismétlődése okoz.
- Antigravitációs izom vagy nem antigravitációs izom. A kisebb, nem antigravitációs izmok (pl. könyökhajlítók) excentrikus edzése után 24 órával akár 50%-os erődeficit is bekövetkezhet (Nosaka és Clarkson, 1996). Ezzel szemben az antigravitációs térdfeszítők edzésénél a deficit mindössze 12% volt (Váczi és mtsai, 2011).
- Az izom rostösszetétele. Azok az izmok, amelyekben nagyobb a gyorsrostok aránya, sérülékenyebbek (Ureczky és mtsai 2014)
A kutatók igazolták, hogyha egy mikrosérülést okozó edzést néhány napon belül megismétlünk, a második edzés már jóval kisebb mértékben okoz mikrosérülést. Ezt a hatást az ismételt edzés hatásának (repeated bout effect) nevezi a szakirodalom. Az izomban az első edzés úgynevezett „védő hatást” (protective effect) vált ki, mely akár 9 hónapig is eltarthat (Nosaka és mtsai, 2001). A szakemberekben sokszor felmerül a kérdés, hogy vajon mi történik, ha az izom edzését a mikrosérülések jelenléte ellenére tovább folytatjuk. Legkorábban Chen és Hsieh (2001) vizsgálták a sorozatedzések mikrosérülésekre gyakorolt hatását. Azt tapasztalták, hogy hét egymás utáni napon végrehajtott excentrikus könyökhajlító edzés által okozott korai erődeficit a hetedik edzésnapra regenerálódott, ugyanúgy, mint annál a csoportnál, akik csak az első edzést végezték. Valószínűsíthető, hogy az egymás utáni edzések korai neurális adaptációt váltottak ki, így a sérült motoros egységek mellett az épek fokozták elektromos aktivitásukat, ami miatt az erő gyorsan visszatért a kiindulási szintre. Ezt később laboratóriumunkban igazoltuk is (Váczi és mtsai, 2011). Egy három edzésnapból, egy pihenőnapból és további négy edzésnapból álló excentrikus quadriceps edzésprogramban azt tapasztaltuk, hogy a quadricpes elektromos aktivitása már a harmadik edzés után fokozódott. Feltételezzük, hogy sorozatedzések esetén az alábbi folyamatok zajlanak le:
- Az első edzés alkalmával egyes motoros egységek megsérülnek, és ezek ideiglenesen kikapcsolnak a működésből, így csökken az erőkifejtés. Az erődeficitet a központi idegrendszer erősebb neurális aktivitással próbálja kompenzálni.
- További edzések végzésekor az ép motoros egységek fokozzák elektromos aktivitásukat, vagy új, addig nem használt egységek kapcsolódnak be. Az erőkifejtő képesség visszatér a kiindulási szintre.
- Az újonnan bekapcsolt egységek is mikrosérüléseket szenvednek, majd ezek is regenerálódnak. Tartós erőnövekedés, edzésadaptáció következik be.
Az izomszövet az egyik leggyorsabban regenerálódó szövet az emberi szervezetben. Fontos megjegyezni, hogy a mikrosérülések során az izomrostok nem halnak el, hanem azok regenerálódnak, normális szarkomerek alakulnak ki újra. Sőt, a legújabb ismereteink szerint a keresztmetszet-növekedéshez és a gyors erőnövekedéshez mikrosérülésket kell kiváltanunk, mert válaszként egy erősebb izomszövet alakul ki.
A mikrosérülések keletkezésekor elindul egy úgynevezett izomjavító (repaire), vagy újrarendeződési (remodelling) folyamat (Yu et al.2003). A folyatmat az izomrostokban található miogén szatellit sejtek aktivizálódásával indul. A szatellit sejtek olyan őssejtek, amelyek nagy számban találhatók az izomrostokban. A mikrosérülés és izomjavítás folyamata az alábbiak szerint zajlik:
- A szokatlan fizikai aktivitás hatására egyes szarkomerek túlnyúlnak, mikroszkopikus változások következnek be.
- Gyulladási folyamatok indulnak be, melyet fájdalomként érzékelünk.
- A miofibrillumok leszakadt részei elhalnak.
- A gyulladás aktiválja a szatellit sejtek egy részét.
- A szatellit sejtek osztódni kezdenek (profliferáció).
- A szatellit sejtek összekapcsolódnak egymással és a sérült miofibrillummal (fuzionálás), kitöltik a sérülés helyét.
- A szatellit sejtek a miofibrillumhoz hasonló szerkezetűvé válnak (differenciálódás), létrejön az ép miofibrillum.
A fenti folyamatot számos hormon (elsősorban növekedési hormonok, mint például a HGF, IGF-I, IGF-II, MGF, FGF) és fehérje szabályozza. A szabályozó fehérjék közül az egyik legismertebb a miosztatin. A miosztatin megakadályozza a szatellit sejtek aktiválását, vagyis gátolja a sérülés javító mechanizmusát. Állatoknál a miosztatin termeléséért felelős gén mutációjával extrém izomnövekedést (hipertrófiát) tapasztaltak a kutatók, vagyis ennek a fehérjének jelentősége van az izom keresztmetszet-növekedésének szabályozásában (McPherron és Lee, 1997). Excentrikus edzés után néhány órán belül csökken a miosztatin mennyisége, ami lehetővé teszi a sérülésjavítást (Costa és mtsai, 2007) és ezzel párhuzamosan a hipertrófiára is lehetőség nyílik. A sorozatedzések során bekövetkező mikrosérülések és a hosszú távú erőedzés során kialakuló izomhipertrófia tehát szorosan összefügg.
A kutatások többsége azt mutatja, hogy a mikrosérülések jelenléte nem jár az izomrostok elpusztulásával (nekrozissal). Tulajdonképpen arról van szó, hogy a szervezet érzékeli, hogy az adott izomban és adott helyen nem a genetikus kódban meghatározott állapotok uralkodnak. Ezért indulnak be a helyreállítási folyamatok, amelyek az izom méretét szabályozó gének aktivitásának megváltozását jelenti.
6.2. Krónikus változások erőedzés hatására
A vázizom erőedzés hatására bekövetkező alkalmazkodási képessége lenyűgöző. Az erőfejlesztő edzésprogramok hatékonyságának ezreiről számolnak be a kutatót. Ma már elfogadott tény, hogy a nagy ellenállás ellen kifejtett izomkontrakciók okozzák a leggyorsabb és legnagyobb mértékű erőnövekedést. Ráadásul az erőedzés bármely korú és edzettségi állapotú embernél alkalmazható, azzal a feltétellel, hogy figyelmbe vesszük az egyén egészségi állapotát, meghatározzuk az optimális terhelési összetevőket, és kellőképp előkészítjük az egyén terhelhetőségét. A sportolók erőedzése mellett a kutatók beszámolnak olyan kutatómunkákról, melyek a nem sportoló populációkban (edzetlen, időskorú, izombeteg, túlsúlyos) alklamazott edzésprogramok hatékonyságát igazolják.
De mégis milyen folyamatok, vagy élettani mechanizmusok vezetnek ahhoz, hogy szokatlan ellenállás rendszeres legyőzésével erőkifejtő képességünk jelentősen nő? Az alábbiakban ezeket a mechanizmusokat részletezzük.
6.2.1. Az izomerő növekedése
Az erőedzés legszembetűnőbb hatása az izom fokozott erőkifejtő képességében mutatkozik. Az erőnövekedés üteme és nagysága számos olyan tényezőtől függ, mint például az edzettségi háttér, az edző személy neme, életkora, vagy az edzés jellege, a terhelési összertevők és az edzés időtartama. Értelmetlen lenne tehát általánosítani, hogy az erőedzés mekkora erőnövekedést okoz, mert a fenti faktorok ezt jelentősen befolyásolják, és a kutatók által közölt eredmények rendkívül nagy variablilitást, akár 0-250%-os erőnövekdést is mutatnak egy adott erőfejlesztő program elvégzése után. Az erőnövekedés edzésmód- és teszt-specifikus. Az izomerőnek számos fajtája és megnyilvánulási módja van: például maximális erő, Robbanékonyerő (explozív erő), reaktív erő, erőállóképesség. Az erőnövekedés edzésmód-specifitása (exercise mode-specificity) azt jelenti, hogy általában amilyen edzésgyakorlatokat hajtunk végre, abban következik be a legnagyobb erőnövekedés. Számos tanulmány alátámasztja például azt, hogy excentrikus kontrakcióval végzett edzés kedvezőbb hatással van az excentrikus erőkifejtésre, mint a koncentrikusra, és a koncentrikus erőfejlesztő edzés is kedvezőbben hat a koncentrikus erőkifejtésre, mint az excentrikusra (Fridén és mtsai 1983, Hortobágyi és mtsai 1996, Higbie és mtsai 1996). Ugyanakkor figylembe kell vennünk azt is, hogy mindkét kontrakciótípussal végzett edzés növekedést okozott a másik kontrakciótípusban mért erőre, vagyis az erőedzésnek a transzferhatása van.
Az erőnövkedés teszt-specifitása azt jelenti, hogy egy adott erőfajtában bekövetkező változás különböző felmérő tesztekben eltérő eredményt mutathat. Mint ahogyan említettük, az erőedzésnek számos transzferhatása lehet. Az egyik vizsgálatunkban labdarúgók hat héten keresztül végeztek reaktív erőfejlesztést (szökdelőedzést) (Váczi és mtsai, 2013). A legnagyobb fejlődést a felugrásteszttel vizsgált reaktív erőben (9%) mértünk, vagyis az edzéshez hasonló mozgásformában és erőkifejtési módozatban. Kisebb fejlődést tapasztaltunk az térdfeszítő izmok maximális erejében (7%), és a legkisebb fejlődés a mozgásgyorsaságban következett be (2%), igazolva az edzés csekély transzferhatását. Az erőnövekedést számtalan élettani változás okozhatja. A következőkben a legfontosabb mechanizmusokat soroljuk fel.
6.2.2. Idegrendszeri (neurális) adaptáció
Az erőedzés hatására elsődlegesen bekövetkező változás a neurális adaptáció (neural adaptation). Már korábban említettük, hogy az agykéregből kiinduló elektromos impulzusok sűrűsége és amplitúdója összefügg az erőkifejtéssel. Az olyan idegrendszerbeli élettani változásokat, amelyek edzés hatására következnek be és erőnövekedést okoznak, neurális adaptációnak nevezzük. A neurális adaptáció elmélete akkor vált igazán érdekessé és kutatottá, amikor felfedezték, hogy az egyik végtag edzése a másik végtag izmaiban is erőnövekedést okozott, holott a másik egyáltán nem volt edzve (DeVires, 1979). A neurális adaptáció mérésére elektromiográfiát (EMG) és erőmérést alkalmaznak a kutatók. Az EMG az izom elektromos aktivitását mutatja, vagyis az izomhoz érkező akciós potenciálok sűrűségét és amplitúdóját. Amennyiben ezek a paraméterek fokozódnak edzés hatására, neurális adaptáció következett be. Két hétig tartó erőedzés elegendő ahhoz, hogy neurális adaptáció következzen be.
6.2.3. Szöveti adaptáció
Az izom szöveti adaptációja azt jelenti, hogy az izom szerkezetében, méretében, összetételében következnek be változások. A leggyakrabban előforduló szöveti változás az izom méretének növekedése, vagy hipertrófia (hypertrophy). A hipertrófia, melyet egyébként a elsősorban az izom keresztmetszetére vonatkoztatunk, úgy következik be, hogy az izomrostok vastagodnak, viszont azok száma nem növekedik. Pontosabban új szarkomerek és miofibrillumok képződnek párhuzamosan a többivel (Paul és Rosenthal, 2002). Így az egyes izomrostok átmérője növekszik, ez által pedig a teljes izom vastagabb lesz. A rostok kétféle módon vastagodhatnak: 1. a kontraktilis fehérjék állománya gyarapszik (miofibrilláris hipertrófia), vagy 2. a szarkoplazmatikus állomány növekszik (pl. glikogénraktárak növekedése).
Előfordulhat olyan hipertrófia is, hogy új szarkomerek sorbakapcsolva alakulnak ki a régi szarkomerekkel, például ha az izmot szokatlanul nyújtott állapotban edzzük. Ilyenkor az izom keresztmetszete változatlan marad, bár mérete hosszirányban növekszik. Szintén új szarkomerek képződhetnek sorosan, ha az izmot megnyújtott állapotban begipszelik (krónikus nyújtás). Az orvosok ezzel próbálják ellensúlyozni az immobilizáció következtében kialakuó izomsorvadást. Amennyiben az izmot rövidült állapotban immobilizáljuk, a sorbakapcsolt szarkomerek száma csökken.
Hipertrófia akkor alakul ki, amikor a fehérje szintézis mértéke meghaladja a fehérje lebontást. Ezt a folyamatot a szatellit sejtek indítják be. Az edzés alatt kialakuló mechanikai feszülés az izomban aktiválja a szatellit sejteket, melyek elkezdenek búrjánzani és összefűződni, majd az izomszövettel azonos szövetté válnak, vagyis ugyanaz a folyamat zajlik le, mint amelyet a mikrosérülések kialakulása esetén megfogalmaztunk. A hipertrófia jóval később (akár 2-3 hónap elteltével) következik be erőedzés közben, mint a neurális adaptáció.
Intenzív erőedzést követően hiperplázia is bekövetkezhet. A hiperplázia az izomrostok hosszirányú kettéhasadását jelenti, vagyis egyetlen izomrostból két különálló izomrost jön létre. Ez meglehetősen ritka jelenség, és elsősorban állatkísérleteknél mutatták ki a kutatók. Tamaki és mtsai (1997) patkányokat edzett, és azt tapasztalták, hogy már az első edzés hiperpláziát okozott. Bár a hiperplázia jelensége elfogadott, a rostok számának növekedése - ha be is következett - olyan kevés, hogy az erőedzés következtében kialakuló teljesítménynövekedés elsősorban a hipertrófiának és a neurális faktorok változásának köszönhető.
A vázizom alkalmazkodóképességéhez, plaszticitásához hozzá tartozik az is, hogy az egyes izomrost típusok átalakulhatnak egy másikba (6.5. ábra), melyet a korábbi elméletekkel szemben ma már számtalan vizsgálat eredménye igazol. A legtöbb bizonyíték a IIA és IIB rostok közötti, illetve az I-esből a II-esbe történő átalakulásról áll rendelkezésünkre, míg az I-ből a IIA-ba történő átalakulás meglehetősen ritka.
Ma már elfogadott tény, hogy az izom használatának felfüggesztése (pl. hosszú ideg való nyugalombahelyezés, űrutazás, gerincsérüléssel járó bénulás, denerváció) következtében a lassúakból gyors izomrostok képződenk (Pette és Staron 1997, Roy és mtsai 1999). Nyilván furcsán hangzik, hogy ilyen mértékű inaktivtás következtében több lesz a gyors rostunk. A gyors rostok ingerlési küszöbe azonban jóval magasabb, mint a lassúaké, vagyis a használaton kívüli rostok nehezebben ingerelehető rostokká fognak átalakulni (I-től a IIB felé).
Az edzés hatására bekövetkező rosttátalakulások iránya attól függ, hogy milyen jellegű az edzés. Az aerob állóképességi edzés a rostok oxidatív enzimkapapcitását, mitokondriumszámát növeli, és a lassú rostok irányába, elsősorban IIB-ből IIA-ba történő átalakulást indukálja (Pette és Staron 1997). Kevés bizonyíték áll rendelkezésünkre azonba, hogy állóképességi edzés hatására a IIA rostokból I-es típus lesz, azonban igazolták a köztes rostok átmeneti lehetőségeit (pl. IIA-ból IIC) (Pette és Staron 1997). Érdekes az a megállapítás, hogy állóképességi edzés hatására a meglévő I-es rostok valamelyest gyorsabbakká válnak anélkül, hogy típusuk megváltozna (Widrick és mtsai 1996).
Nagy intenzitású erőedzés hatására, ahol az izomrostokat nagy feszülés éri, az állóképességi edzéshez hasonló átalakulás megy végbe, vagyis a gyors rostokból lassúak lesznek (Kreamer és mtsai 1996). Az erőedzés a magas idegrendszeri ingerlés következtében a nehezen ingerelhető IIB rostokat is „kihasználja”, majd utána alaccsonyabb ingerelhetőségű rosttá alakítja azokat. Fry és mtsai (2003) élvonalbeli erőemelők térdfeszítő izomzatából vett biopsziában csak elvétve (1%) találtak IIB rostot edzetlen kontrol személyekhez képest (12%). Fontos megjegyeznünk, hogy bár az állóképességi és erőedzés azonos irányú rostátalakulást kezdeményez, a roston belüli adaptációs mechanizmusok mégis eltérőek. Az erőedzés hipertrófiával, vagyis az egyes rostok vastagodásával is jár, ugyanis nő a miofibrillumok száma. Ezzel szemben az állóképességi edzés nem okoz hipertrófiát. Az erőedzés elsősorban a glikolítikus, az állóképességi edzés pedig az oxidatív anyagcserefolyamatokat javítja.
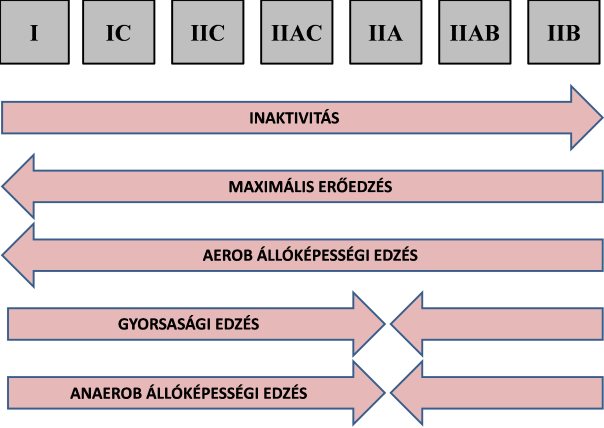
6.5. ábra. A különböző edzésfajták hatására várható rostátalakulási irányok. Megjegyzés: a nyilak átalakulási irányt mutatnak.
6.3. Az öregedés hatása
Az öregedés neuromuszkuláris rendszerre gyakorolt hatása visszafordíthatatlan, viszont késleltethető biológiai folyamat. Idős korban a fizikai állapot hanyatlása a mozgásképesség elveszítéséhez vezethet. A vázizmok megfelelő működése a mindennapi tevékenységünk, tehát az élet feltétele. Az öregedéssel együtt járó fiziológiai változások közül az egyik legfenyegetőbb az időskori szarkopénia (ageing induced sarcopenia). A fogalom eredeti, görög szóból származó jelentése („sarcos” = hús, „penia” = valaminek a hiánya) a vázizom tömegének csökkenésének és az izomerő elveszítésének együttes megjelenése. Ez utóbbi jelenséget, mely a teljes neruomuszkukáris rendszer csökkent működésére vonatkozik, dynapéniának és nevezzük. A kutatók gyakran használják még az atrófia (atrophy) szót, mely az izomtömeg csökkenését jelenti. Tehát a szarkopénia a dynapénia és az atrófia együttes megjelenése.
A szarkopénia okait és következményeit számos (molekuláris, sejt, szövet és funkcionális) szinten vizsgálják, és ezeknek a befolyásoló faktoroknak a száma szinte végtelen. Maguk a molekuláris, valamint sejt- és szöveti módosulások a fizikai képességek (erő, állóképesség, gyorsaság) csökkenését eredményezik, melyek közvetlenül befolyásolják az egyén életviteléhez szükséges alapvető funkcionális kapacitást (6.6. ábra). A mozgásképesség csökkenése miatt a normális hétköznapi cselekvések jelentős fáradást okoznak, amelyhez jelentős motivációvesztés, valamint sérülésektől, balesetektől való félelem is párosulhat. Mindez tovább csökkenti a fizikai aktivitást, mely újabb szarkopénikus folyamatokat indít be, és a körforgás folytatódik.
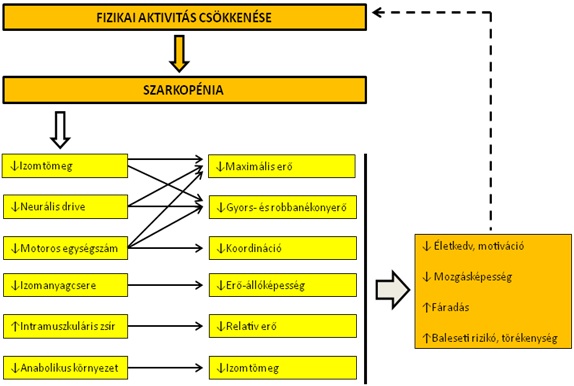
6.6. ábra. Az öregedő izom szarkopéniájának élettani és funkcionális komponensei (Váczi, 2014).
A maximális erő legalább ugyanakkora, vagy nagyobb ütemben csökken az életkor előrehaladásával, mint az izom keresztmetszete (Frontera és mtsai, 1991). A kutatások szerint a férfiaknál már 20 éves kor után elkezdődik az izometriás erő csökkenése, nőknél azonban ez csak a 40 éves kor környékén tapasztalható (Danneskiold-Samsoe és mtsai, 2009). Érdekes, hogy idős korban az excentrikus (fékező) erőkifejtés viszonylag megtartott (Roig és mtsai, 2010), szemben a koncentrikussal, ami a kötőszövet megvastagodásával magyarázható.
A maximális akaratlagos erőkifejtő képesség elsősorban az izomkeresztmetszet csökkenése miatt hanyatlik. 18 és 80 éves kor között az izomtömeg 8-49 %-kal csökkenhet, attól függően, hogy melyik izmot vizsgálják (Tzankoff és Norris, 1977). Érdekes, hogy mind a férfiaknál, mind pedig a nőknél az izomvesztés nagyobb ütemben megy végbe az alsó végtagokban, mint a felsőtestben. Mitchell és mtsai (2012) a legutóbbi ötven év gerontológiai tanulmányait összefoglalva megállapították, hogy a férfiak 4,7%, a nők pedig 3,7% izomtömeget veszítenek el évtizedenként. A harmadik évtizedben a testzsír tömegének növekedése miatt jelentősen csökken a relatív izomtömeg. A relatív izomerő (testtömeghez viszonyított erő) csökkenése a test hordozását nehezíti meg, és ennek következtében csökken a napi fizikai aktivitás.
Az öregedő izom sorvadásának két legfontosabb karakterisztikája az izomrostok számának (hipoplázia) és keresztmetszetének a csökkenése. Az izomrostok száma az ember érési periódusának végétől kb. 50 éves korig nem változik, majd az öregedéssel folyamatosan csökken. 50 és 80 éves kor között a vastus medialis izomba 50%-os rostszám csökkenést becsültek (Lexell és mtsai, 1988).
A korábban ismertetett erő-sebesség összefüggés görbe (Hill-görbe) balra tolódik el az életkor előrehaladásával, ami alátámasztja azt a tényt, hogy a II-es típusú izomrostok atrófiája, vagy akár elveszítését nagyobb, mint az I-es rostoké (Thom és mtsai, 2005). Ez azt jelenti, hogy ugyanakkora erőt az öregedő izom kisebb sebesség mellet képes kifejteni. Ráadásul az izom mechanikai teljesítményét e két paraméter (erő és sebesség) szorzata adja, vagyis a teljesítmény hatványozottan csökken a maximális erő és a kontraktilitási sebesség csökkenéséhez képest. A II-es típusú rostok szelektív atrófiája nemcsak a gyorserő, hanem ez explozív, vagy robbanékonyerő csökkenését is okozza.
Idős állatoknál igazolták a kutatók, hogy izomzatukból komplett motoros egységek tűnnek el. Először a motoros egységhez tartozó rostok elveszítik beidegzésüket (denerváció), majd elhalnak. Ugyanakkor egyes denervált, de még életben lévő gyors rostokat lassú motoros egységek motoneuronjai idegezhetnek be újra (Brown és mtsai, 1981). És mivel a rost típusát az általa beidegző neuron határozza meg, ezért ezek a rostok lassú típussá alakultak át. Így az épen maradt (lassú) motoros egységekhez tartozó rostok száma átlagosan nő, ami a sebességvesztés mellett koordinációromlást is eredményez.
A gerontológusokat és a terapeutákat régóta foglalkoztatja az, hogy a mozgatórendszer öregedése miatt bekövetkező mozgásképesség elvesztése hogyan lassítható, a mozgásképesség elvesztése ugyanis jelentősen kihat az egyén életvitelére és környezetére. A mobilitás megőrzésére célzott hormonális kezelések csak legvégső esetben indikáltak, és egyébként is az anabolikus hormonterápiák csak enyhe növekedést eredményeznek az erőkifejtő képességben (Morales és mtsai, 1998). A kutatók körében már elfogadott az, hogy elsősorban erőfejlesztő edzés a legalkalmasabb a szarkopénia kezelésére és megelőzésére. Bár önmagában már az állóképességi edzés is jelentős változást eredményezhet az izomerőben és bizonyos funkcionális paraméterekben, mint a járássebesség (Sipila és mtsai, 1996), a kutatásokban jelentős áttörést jelentettek az olyan edzéstanulmányok, amelyek egyértelműen igazolták, hogy a nagy intenzitású (a maximális erőkifejtő képesség 80%-val végrehajtott) súlyzós erősítő edzés biztonságos, és nagyarányú erőnövekedést és funkcionális javulást eredményez időseknél (Urban és mtsai, 1995).
ÖSSZEFOGLALÁS
- Fáradás alatt a vázizom fizikai aktivitás alatt vagy után bekövetkező erőkifejtésének csökkenését értjük.
- Perifériás fáradásnak nevezzük a neuromuszkuláris szinapszis utáni szakaszban, vagyis az izomban bekövetkező élettani változásokat. Perifáriás fáradáskor az erőcsökkenést elsősorban az izomban létrejövő energiaforrások kimerülése, a kalcium mobilizáció csökkenése, vagy mikrosérülések okozhatják.
- Centrális fáradásnak nevezzük a motoros agykéreg és a neuromuszkuláris szinapszis közötti szakasz megváltozott élettani működésést (csökkent neurális „dirve”, ingerületvezetési sebesség és erősség).
- Mikrosérülések alatt az izom edzésére (elsősorban excentrikus edzésre) bekövetkező, mikroszkópikus változásokat értjük, mely a szarkomer fehérjéit, a sejtmembránt, vagy a tubuláris rendszert érinti. Mikrosérülések után a regeneráció néhány napon belül bekövetkezik.
- Hipertrófia alatt a vázizom méretének növekedését értjük, melyet elsősorban az izomkeresztmetszetre vonatkoztatunk.
- A hiperplázia az izomrostok számának növekedését jelenti. A rostok száma úgy növekszik, hogy egyes rostok hosszirányban kettéhasadnak.
Irodalomjegyzék
Armstrong RB (1984) Mechanisms of exercise-induced delayed onset muscle soreness: a brief review. Medicine and Science in Sports and Exercise 16, 529-38.
Barker AT, Jalinous R, Freeston IL (1985) Non-invasive magnetic stimulation of human motor cortex. Lancet, 1, 1106-1107.
Brenner IKM, Natale VM, Vasilou P, Moldoveanu AI, Shek PN, Shephard RJ (1999) Impact of three different types of exercise on components of the inflammatory response. European Journal of Applied Physiology 80, 452-460.
Brown MC, Holland RL, Hopkins WG (1981) Motor nerve sprouting. Annual Review of Neuroscience, 4, 17-42.
Chapman D, Newton M, Sacco P, Nosaka K (2006) Greater muscle damage induced by fast versus slow velocity eccentric exercise. International Journal of Sports Medicine, 27, 591-598.
Chen TC, Hsieh SS (2001) Effects of a 7-day eccentric training period on muscle damage and inflammation. Medicine and Science in Sports and Exercise, 33, 1732-1738.
Clarkson PM, Byrnes WC, McCormick KM, Turcotte LP, White JS (1986) Muscle soreness and serum creatine kinase activity following isometric, eccentric, and concentric exercise. International Journal of Sports Medicine, 7, 152-155.
Clarkson PM, Nosaka K, Braun B (1992) Muscle function after exercise induced muscle damage and rapid adaptation. Medicine and Science in Sports and Exercise, 24, 512-520.
Costa A, Dalloul H, Hegyesi H, Apor P, Csende Z, Rácz L, Váczi M, Tihanyi J (2007) Impact of repeated bout of eccentric exercise on myogenic gene expression. European Journal of Applied Physiology, 101, 427-436.
Danneskiold-Samsoe B, Bartels EM, Bülow PM (2009) Isokinetic and isometric muscle strength in a healthy population with special reference to age and gender. Acta Physiologica, 197(Suppl. 673), 1–68.
Fridén J, Lieber RL (1992) Structural and mechanical basis of exercise-induced muscle injury. Medicine and Science in Sports and Exercise, 24, 521-530.
Frontera WR, Hughes VA, Lutz KJ, Evans WJ (1991) A cross-sectional study of muscle strength and mass in 45- to 78-year-old men and women. Journal of Applied Physiology 71, 644-650.
Fry AC, Webber JM, Weiss LW, Harber MP, Vaczi M, Pattison NA (2003) Muscle fiber characteristics of competitive power lifters. Journal of Strength and Conditioning Researc, 17, 402–410.
Hough T (1902) Erfographic studies in muscular soreness. American Journal of Physiology 7, 76-92.
Kraemer WJ, Fleck SJ, Evans WJ (1996) Strength and power training: physiological mechanisms of adaptation. Exercise and Sport Science Reviews, 24, 363–397.
Lexell J, Taylor CC, Sjostrom M (1988) What is the cause of the ageing atrophy? Total number, size and proportion of different fiber types studied in whole vastus lateralis muscle from 18- to 83-year-old men. Journal of Neurology Science, 84, 275-294.
McPherron, Lee S (1997) Double muscling in cattle due to mutations in the myostatin gene. Proceedings of the National Acady of Sciences of the United States of America, 94, 12457-12461.
Mitchell WK, Williams J, Artherton, P, et al (2012) Sarcopenia, dynapenia, and the impact of advancing age on human skeletal muscle size and strength; a quantitative review. Frontiers in Physiology, 3, 1-17.
Morales AJ, Haubrich RH, Hwang JY, Asakura H, Yen SS (1998) The effects of six months treatment with a 100mg daily dose of dehydroepiandrosterone (DHEA) on circulating sex steroids, body composition and muscle strength in age-advanced men and women. Clinical Endocrinology (Oxf), 49, 421-432.
Muramaya M, Nosaka K, Yoneda T, Minamitani K (2000) Changes in hardness of the human elbow flexor muscles after eccentric exercise. European Journal of Applied Physiology, 82, 361-367.
Nosaka K, Clarkson PM (1996) Changes in the indicators of inflammation after eccentric exercise of the elbow flexors. Medicine and Science in Sports and Exercise, 28, 953-961.
Nosaka K, Sakamoto K, Newton M, Sacco P (2001) How long does the protective effect on eccentric exercise-induced muscle damage last? Medicine and Science in Sports and Exercise, 33, 1490-1495.
Nosaka K, Sakamoto K (2001) Effect of elbow joint angle on the magnitude of muscle damage to the elbow flexors. Medicine and Science in Sports and Exercise, 33, 22-29.
Paul AC, Rosenthal N (2002) Different modes of hypertrophy in skeletal muscle fibers. Journal of Cell Biology 18, 751–760.
Pette D, Staron RS (1997) Mammalian skeletal muscle fiber type transitions. International Review of Cytology, 170, 143–223.
Roig M, Macinyre DL, Eng JJ, Narici MV, Maganaris CN, Reid WD (2010) Preservation of eccentric strength in older adults: evidence, mechanisms and implications for training and rehabilitation. Experimental Gerontology 45, 400-409.
Roy RR, Talmadge RJ, Hodgson JA, Oishi Y, Baldwin KM, Edgerton VR. Differential response of fast hindlimb extensor and flexor muscles to exercise in adult spinalized cats. Muscle and Nerve, 22, 230–241.
Safran MR, Seaber AV, Garrett Jr, WE (1989) Warm-up and muscular injury prevention. Sports Medicine, 8, 239-249.
Saxton JM, Clarkson PM, James R (1995) Neuromuscular dysfunction following eccentric exercise. Medicine and Science in Sports and Exercise, 27, 1185-93.
Seger JY, Arvidsson B, Thorstensson A (1998) Specific effects of eccentric and concentric training on muscle strength and morphology in humans. European Journal of Applied Physiology, 79, 49-57.
Sipila S, Multanen J, Kallinen M, Era P, Suominen H (1996) Effects of strength and endurance training on isometric muscle strength and walking speed in elderly women. Acta Physiologica Scandinavica, 156, 457-464.
Tamaki T, Akatsuka A, Tokunaga M, Ishige K, Uchiyama S, Shiraishi T. Morphological and biochemical evidence of muscle hyperplasia following weight-lifting exercise in rats. American Journal of Physiology, 273, C246-256.
Thom JM, Morse CI, Birch KM, Narici MV (2005) Triceps surae muscle power, volume, and quality in older versus younger healthy men. The Journals of Gerontology, series A, Biological Sciences and Medical Sciences, 60, 1111-1117.
Taylor JL, Gandevia SC (2008) A comparison of central aspects of fatigue in submaximal and maximal voluntary contractions. Journal of Applied Physiology, 104, 542-550.
Tzankoff SP, Norris AH (1977) Effect of muscle mass decrease on age-related BMR changes. Journal of Applied Physiology, 43, 1001-1006.
Urban R, Bodenburg Y, Gilkinson C, et al (1995) Testosterone administration to elderly men increases skeletal muscle strength and protein synthesis. American Journal of Physiology 269, E820-826.
Ureczky D, Vácz G, Costa A, Kopper B, Lacza Z, Hortobágyi T, Tihanyi J (2014) The effects of short-term exercise training on peak-torque are time- and fiber-type dependent. Journal of Strength and Conditioning Research, 28, 2204–2213.
Váczi M, Tihanyi J, Hortobágyi T, Rácz L, Csende Zs, Costa A, Pucsok J (2011) Mechanical, biochemical, and EMG responses to short-term eccentric-concentric knee extensor training in humans. J Strength Cond Res, 25, 922-932.
Váczi M, Tollár J, Meszler B, Juhász I, Karsai I (2013) Short-term high intensity plyometric training improves strength, power, and agility in male soccer players. Journal of Human Kinetics, 36, 17-26.
Váczi M, Tihanyi J, Rácz L, Pucsok J (2003) Egyhetes nyújtásos-rövidüléses edzés hatása az izom mechanikai és biokémiai mutatóira. IV. Országos Sporttudományi Kongresszus, Szombathely.
Váczi M (2014) Az időskori szarkopénia mechanizmusa és kezelési stratégiái. Népegészségügy 92, 34-43.
Warren GL, Lowe DA, Armstrong RB (1999) Measurement tools used in the study of eccentric contraction-induced injury. Sports Medicine, 27, 43-59.
Widrick JJ, Trappe SW, Blaser CA, Costill DL, Fitts RH (1996) Isometric force and maximal shortening velocity of single muscle fibers from elite master runners. American Journal of Physiology, 271, C666–C675.
| « Előző fejezet | Tartalomjegyzék | Következő fejezet » |
Események
Jelenleg nincs aktuális esemény.

















