TÁMOP-4.1.2.E-13/1/KONV-2013-0012
"Sporttudományi képzés fejlesztése
a Dunántúlon"
- -> Tananyagfejlesztés
- -> Mozgásszabályozás
- -> 2.
2.
2. Az idegrendszer működésének alapjai
- 2.1 Az idegsejt (neuron) felépítése
- 2.2. Az ioncsatornák
- 2.3. A nyugalmi membránpotenciál kialakulása
- 2.4. Az akciós potenciál kialakulása
- 2.5. Az akciós potenciál terjedése
- 2.6. Az akciós potenciál átadása
Az idegrendszer idegszövetből épül fel, melynek legfontosabb építőelemei az idegsejtek.
2.1 Az idegsejt (neuron) felépítése
A neuronok feladata a szervezeten belüli „üzenetközvetítés. A neuron az információkat általában kémiai jelként, ingerület átvivő anyag ( neurotranszmitter) felszabadításával adja tovább. A neuronok részei (2-1. ábra): sejttest (perykarion vagy soma), melyben sejtmag (nucleus), ill. különböző sejtalkotók (pl.: Nissl szemcsék) figyelhetők meg.
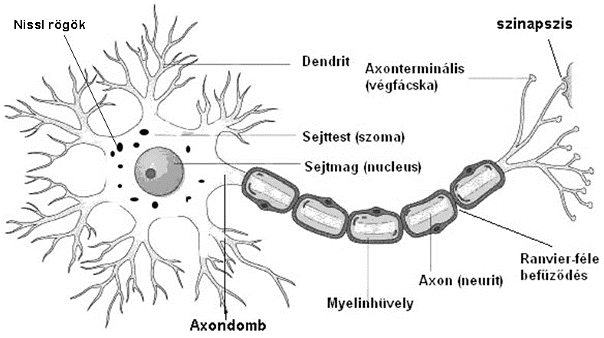
2-1. ábra: Az idegsejt (neuron) általános szerkezete
Több sejttest elkülönülve ún. magokat (nucleus) alkot a központi-, míg dúcokat (ganglion) a környéki idegrendszerben. A sejttestekből egyrészt gyökérszerű rövid nyúlványok, dendritek ágaznak ki, másrészt egy hosszú nyúlvány az axon ( neurit). Az axon kilépési helye kúpszerű, melyet axondombnak nevezünk. Több axon együttesen alkotja a központi idegrendszerben az ún. pályákat, míg a környéki idegrendszerben az idegeket. A központi idegrendszerben a pályák hozzák létre az ún.fehérállományt, a sejttestek összessége a szürkeállományt. Az axon vége az axonterminális (végfácska, telodendrion), ami kapcsolatot, szinapszist alakíthat ki más idegi, vagy nem idegi eredetű sejtekkel.
A neuronokat alakjuk és működésük alapján csoportosíthatjuk.
Alak szerint lehetnek:
- nyúlvány nélküli (apoláris) idegsejtek, pl.: neuroblasztok,
- egynyúlványú (unipoláris) idegsejtek, pl.: bélidegrendszer egyes idegsejtje,
- álegynyúlványú (pszeudounipoláris) idegsejtek, pl.: érzőidegek, melyek sejttestjei a csigolyaközti dúcban (ganglion spinale) találhatók (lásd 3-3. ábra, illetve 3-4. ábra)
- kétnyúlványú (bipoláris) idegsejtek, pl. a VIII. agyideg mindkét dúcában, vagy a retinában
- soknyúlványú (multipoláris) idegsejtek, pl.: nagyagyi piramissejtek.
Működési felosztásuk szerint az idegsejtek:
- érző (szenzoros-),
- összekötő (inter-),
- mozgató (effektorikus-) neuronok lehetnek.
Az idegszövet felépítésében a neuronokon kívül, a gliasejtek vesznek részt, melyek többek között táplálják, védik a neuronokat, illrtvr részt vesznek a myelinhüvely szintézisében. Az axont és az azt körülvevő velőshüvelyt idegrostnak nevezzük. Mind a központi, mind a perifériás idegrendszerben az axonok körül gliasejtek alakítanak ki hüvelyt. Ezek a gliasejtek a központi idegrendszerben az oligodendrogliasejtek, a perifériás idegrendszerben pedig a Schwann-sejtek.
Az axonok hüvely szerinti csoportosítása:
- Schwann-myelinhüvelyes rostok, pl.: perifériás idegrostok nagy része
- myelinhüvelyes rostok, pl.: a központi idegrendszer fehérállományában található idegrostok
- csupasz idegrost ok, melyekben az axonok közvetlenül érintkeznek a sejten kívüli térrel, pl.: fájdalomérző axonok
*Kiegészítés: A sclerosis multiplex (SM vagy MS) a központi idegrendszer autoimmun, gyulladásos megbetegedése. Az SM betegségben a nem megfelelően működő immunrendszer, az idegsejtek axonjait burkoló velőshüvelyt támadja meg, feloldva, elroncsolva azt. Ennek következtében az idegsejt lassabban vezeti, vagy teljesen blokkolja az ingerületet. A betegség a központi idegrendszer összes pályarendszerét érinti. A plakkok okozta károsodások miatt a tünetek a következők lehetnek:homályos és kettős látás, rosszul érthető beszéd, nyelészavar, végtaggyengeség, illetve mozgatási nehézség, egyensúlyzavar, ülés, állás vagy járás közben a test felületén érzett zsibbadás, végtagbénulás, végtagok (kéz) remegése.
2.2. Az ioncsatornák
Az idegsejtek transzmembrán folyamatok közreműködésével tartják fent a kapcsolatot a sejten belüli (intracelluláris), ill. a sejten kívüli (extracelluláris) tér között. Ezeket a szabályozott membránon keresztül zajló folyamatokat ioncsatornák teszik lehetővé.
Működésük alapján az alábbi ioncsatornákat tudjuk megkülönböztetni:
- transzmitterfüggő ioncsatorna, mely csak egy rá jellemző transzmitter kapcsolódásakor nyílik, pl.: nikotin-típusú acetilkolin receptor (nAChR),
- feszültségfüggő ioncsatorna, mely a membrán polaritásának megváltozására nyílik, pl.: feszültségfüggő Na+-csatorna,
- energiát igénylő ioncsatorna, mely ATP molekula hasításakor nyílik, pl.: Na+/K+-pumpa,
- mechanikus ioncsatorna, a membrán feszülésének hatására nyílik, majd a feszülés megszűnésekor a csatorna bezárul, pl.: hallójárat szőrsejtjeiben.
2.3. A nyugalmi membránpotenciál kialakulása
Állatkísérletek bizonyították, hogy ha a nyugalomban levő idegroston kívüli térbe (2-2/B. ábra) helyeztek két elektródát, és azokat megfelelő erősítőn keresztül összekötötték, nem találtak feszültséget (potenciálkülönbség). Ha az ingerlő elektródákat a sejt belsejébe (2-2/A. ábra) juttatták, abban az esetben sem jelentkezett potenciálkülönbség. Az egyik elektród beszúrása után (2-2/C. ábra) azonban egy állandóan mérhető potenciálkülönbség volt tapasztalható a membrán külső és belső felszíne között, melyet nyugalmi membránpotenciálnak nevezünk.
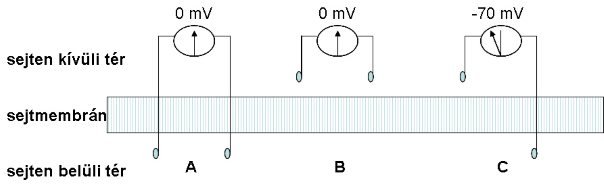
2-2. ábra: A sejtmembrán két oldala között mérhető potenciálkülönbség
A: Mindkét elektród a sejt belsejében, nincs potenciálkülönbség, B: A: Mindkét elektród a sejten kívüli térben, nincs potenciálkülönbség, C: Egy elektród a sejt belsejében, egy elektród a sejten kívüli térben, -70mV-os potenciálkülönbség,
A sejtmembrán két oldalán különböző ioneloszlás tapasztalható. Ez a membrán különböző mértékű ionáteresztő képességének (permeábilitás) köszönhető. A sejten kívüli (extracelluláris) térben a Na+, Ca2+, illetve a Cl--ionok, míg a sejten belüli (intracelluláris) térben a K +-ion, és. a fehérje-anionok - melyek a sejt belsejének negatívabb töltést biztosítanak - találhatók nagyobb koncentrációban. Az ionok a koncentráció gradiensüknek megfelelően, azaz a nagyobb koncentrációjú helyről a kisebb koncentrációjú hely felé, az ún. szivárgó ioncsatornákon keresztül vándorolnak a membránon át. A folyamat energia-befektetést nem igénylő, passzív transzport. Egy idő után a szivárgó csatornán keresztül történő ionvándorlás eltérő ionkoncentrációt hozna létre. A sejt állandó állapotának fenntartásában elsősorban aNa+/K+-pumpa segít. A pumpa 3 Na+-iont pumpál a sejt belsejéből a sejten kívüli térbe, míg 2 K +-iont hoz be a sejten kívüli térből a sejt belsejébe. Ez a működés az ionok koncentráció gradiensük ellenében történik, így a pumpa csak energia befektetés mellett képes ellátni feladatát. Az ehhez szükséges energia ATP bontásából származik. A folyamat aktív transzport
A membránnal elválasztott terek elektromos semlegességének fenntartásához negatív töltésű ionok is kellenek. A sejten belüli térben negatív töltésű fehérjék találhatók. Mivel ezeknek a fehérjéknek a mérete viszonylag nagy (ún. óriásmolekulák), így nem képesek a sejtmembránon át történő vándorlásra. A Cl--ion kismértékű diffúziójának, ill. kicsi koncentrációkülönbségének köszönhetően nem befolyásolja jelentősen az ionegyensúlyt a membrán két oldala között.
A két pozitív ion (Na+, K+) eltérő eloszlásának következtében, a külső membránfelszín pozitívabb lesz a belső felszínhez képest. Így a membrán két oldala között potenciálkülönbség, nyugalmi membránpotenciál mérhető, melynek értéke sejttípustól függően -50--90mV (2-3. ábra).

2-3. ábra: A nyugalmi membránpotenciál kialakulásának vázlata
A sejtmembrán nyugalmi potenciálját a Goldman-Hodgkin-Katz egyenlet (GHK-egyenlet, 2-4. ábra) adja meg.

2-4. ábra: A GHK egyenlet
Ahol, Vm, a nyugalmi membránpotenciál (elektromotoros erő), R, az egyetemes gázállandó, T, az abszolút hőmérséklet, z, a töltésszám, F, a Faraday-féle állandó, P, az egyes ionok membrán permeábilitása, „o” index, az ionok külső, „i” index, az ionok belső koncentrációi, ln pedig a természetes alapú logaritmus.
Az egyenlet kimondja, hogy ha egy ionfajta koncentrációja, vagy az adott ionra nézve a membrán permeábilitása növekszik, akkor nő a szerepe a membránpotenciál kialakításában is. A GHK-egyenlet nemcsak nyugalomban, hanem az idegsejtek, ideg- és izomrostok minden pillanatnyi állapotában alkalmazható.
2.4. Az akciós potenciál kialakulása
Ha inger éri az idegsejtet, akkor a sejt membránjának permeábilitása több százszorosára fokozódik, a Na+-ionok a nagyobb koncentráció irányába, azaz a sejt belseje felé kezdenek vándorolni. A Na+-ionok sejtbe történő áramlásának következtében változik a töltéseloszlás a membrán két oldalán, a membrán depolarizálódik. Amikor a membránpotenciál elér egy kritikus értéket, nyílnak a feszültségfüggő Na+ -csatornák, kialakul az ún. akciós potenciál (AP, 2-5. ábra). Azt a kritikus feszültségértéket, mely kiváltja az AP bekövetkezését,ingerküszöbnek nevezzük. Amennyiben a depolarizáció elérte a fent említett küszöbértéket, az AP mindenképp bekövetkezik, amit az AP „minden vagy semmi” törvényének nevezünk. Ez azt jelenti, hogy amennyiben a sejtre érkező inger nem éri el az ingerküszöböt, akkor nem alakul ki AP („semmi” állapot), ha azonban a depolarizáció mértéke eléri, akkor mindig ugyanakkora potenciálváltozás mérhető az adott sejt membránján („minden állapot”). A sejten kívüli térben elhelyezkedő Na+-ionok a sejtbe történő beáramlása átpolarizálja a membránt. Amikor a legnagyobb pozitív potenciál mérhető a sejtmembránon, akkor csúcspotenciálról (tüske, „spike”) beszélünk, melynek értéke körülbelül +30-40 mV. Egy idő után a fokozott Na+-permeábilitás lecsökken, a csatorna inaktiválódik, mellyel párhuzamosan az axon membránja a K+-ionokra lesz permeábilis.
*Kiegészítés: 1.) Néhány állati eredetű toxin, pl. skorpió toxinja állandóan nyitva tudja tartani a Na+-csatornákat. 2.) A rovarkártevők ellen bevezetett DDT (diklór-difenil-triklóretán) ezeket a feszültséggfüggő Na+-csatornákat stimulálja. Mérgezése esetén remegés, mozgáskoordinációs zavar, ill. görcsös állapot észlelhető. A DDT lassú lebomlása miatt napjainkban is jelentősen terheli a bioszférát.
A csúcspotenciál elérése után a K+-ionok a koncentráció-grádiens irányába, azaz a sejt belsejéből, a sejten kívüli tér felé kezdenek áramlani feszültségfüggő K+-csatornákon keresztül. Mivel pozitív ionok áramlanak ki a sejtből, a membránpotenciál negatív irányba tolódik, melyet repolarizációnak nevezünk. A K+-ionok kiáramlásával a Cl--ionok beáramlása tart egyensúlyt. A K+ sejtből történő kiáramlása, ill. a Cl--ionok sejtbe történő beáramlása miatt, a potenciálkülönbség értéke a nyugalmi potenciál értékénél is alább száll, melyet utóhiperpolarizációnak nevezünk.
A fenti folyamatok eredményeképpen a töltéseloszlás, így a membránpotenciál visszaáll az eredeti értékre, de az ioneloszlás még különbözik a kiindulási, nyugalmi helyzettől. Ebben az állapotban, a sejt belsejébe Na+-ionokat, a sejten kívül K+-ionokat találunk a kiindulási értéknél nagyobb koncentrációban. Az eredeti ioneloszlás visszaállítását a Na+/K+-pumpa végzi. A pumpa ATP bontásából származó energia felhasználásával 3 Na+-iont juttat a sejt belsejéből a sejten kívüli térbe, míg ezzel párhuzamosan 2 K+-iont juttat a sejtbe. A pumpa működése energiafelhasználás szempontjából aktív transzport. Újabb AP kialakulásához idő szükséges (refrakter periódus), mert az ionpumpának helyre kell állítania az eredeti ioneloszlást. Az AP folyamata rendkívül gyorsan, körülbelül 3-4 ms alatt zajlik le.
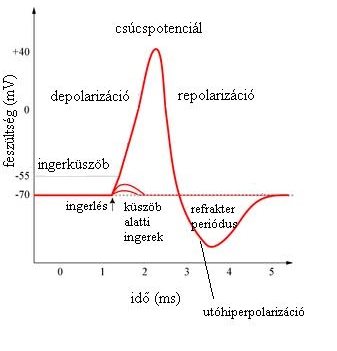
2-5. ábra: Az akciós potenciál vázlatos rajza
2.5. Az akciós potenciál terjedése
Az ingerületek keletkezése mellett az idegsejtek elemi működéséhez tartozik az ingerület vezetése is. A tovaterjedés általában a sejttest felől, az axoneredési dombról (2-1. ábra) indul, s az axon-végződések felé halad. A tovaterjedés sebessége meghatározza az ingerületvezetés sebességét. Az ingerületterjedés a következőképpen valósulhat meg:
- pontról–pontra (csupasz, velőhüvely nélküli membránszakaszokon),
- befűződésről-befűződésre („szaltatórikusan” ugrálva, velőhüvellyel borított membránszakaszokon).
A pontról pontra terjedés viszonylag lassú folyamat (lásd. 2-1. táblázat, C-rostok). Az egymást követő membránrészleteken kiváltott elektromos impulzusok hullámszerűen terjednek a neuronon. Az ingerületterjedés sebességét egyrészt az axon átmérőjének növelése befolyásolja. Minél nagyobb a rost belső átmérője - kisebb az ellenállása -, annál nagyobb a rost vezetési sebessége. Mivel az axon átmérője csak bizonyos határig növelhető, így hatékonyabb módszer a vezetési sebesség fokozására, az ún. szaltatórikus vezetés (2-6. ábra). Megvalósulását a myelinhüvely kialakulása teszi lehetővé. A velőhüvelyes rostok fejlődése során a Schwann-sejtek többszörösen az axon köré csavarodva „szigetelik” azt. Az így kialakult velőhüvely néhány mm-en keresztül folyamatosan burkolja az axont. A szigetelések között bizonyos szakaszokon (körülbelül 0,5-1µm) az axon csupasz marad, melyet Ranvier-féle befűződéseknek (csomó, nodus) nevezünk. Ezeknél a befűződéseknél az axon membránja közvetlenül érintkezik a sejten kívüli térrel, és mivel csak itt találhatók feszültségfüggő Na+-csatornák, ezért kizárólag ezeken a helyeken tud AP kialakulni. Két Ranvier-féle befűződés között helyezkedik el az internodium. A velőhüvelyes idegrostokban az ingerületvezetés nagyon gyors is lehet, elérheti a 100-120m/s nagyságrendet is (lásd. 2-1. táblázat)

2-6. ábra: A szaltatórikus vezetés vázlata
Az idegrost vastagsága és vezetési sebessége alapján elkülöníthetünk (Erlanger-Gasser nyomán, 1944 Nobel-díj):
- vastag, myelinhüvelyes A-rostokat
- vékony, myelinhüvelyes B-rostokat
- még vékonyabb, myelinhüvely nélküli C-rostokat
| ROSTTÍPUSOK |
ÁTLAGOS ÁTMÉRŐ (µm) |
VEZETÉSI SEBESSÉG (m/s) |
|
| velőhüvelyes rostok | Aαφ | 15 | 70-120 |
| Aβ | 8 | 30-70 | |
| Aχ | 5 | 15-30 | |
| Aδ | 3 alatt | 12-30 | |
| B | 3 | 3 | |
|
velőtlen rostok C |
1 alatt | 0,5-2 | |
2-1. táblázat: Az idegrostok Erlanger-Gasser-szerinti csoportosítása
2.6. Az akciós potenciál átadása
2.6.1. Idegvégződések
Az idegsejtek axondombján keletkezett ingerület egyirányúan a sejttest felől az axonterminális (végfácska) felé vezetődik. A neuronok végrészei az idegvégződések, melyek a felvevő, végrehajtó, ill. maguk a neuronok között létesítenek kapcsolatot. Ezek alapján terminális és interneuronális (neuronok közötti) idegvégződéseket tudunk megkülönböztetni. A terminális idegvégződéseket a különböző szöveti elhelyezkedésük alapján csoportosíthatjuk. Ennek megfelelően hám-, kötő- és izomszövetben előforduló idegvégződésekről beszélhetünk. Az interneuronális idegvégződések, mint a neve is mutatja, magában az idegszövetben találhatók. Ha az idegrostok idegvégződései a végződés helyén az adott szövetben semmiféle változást nem idéznek elő, akkor szabad idegvégződésről, ha az általuk módosított sejtekkel együtt alaktani egységet hoznak létre, akkor idegvégtestről beszélünk.
A/ A hámszövet idegvégződései:
- szabad idegvégződések, melyek valószínű, hogy a fájdalomérzékelés receptorai,
- idegvégtestek, a Merkel-féle testek, amik a tapintás és nyomásérzésben vesznek részt (mechanoreceptorok).
B/ A kötőszövet idegvégződései:
-
szabad idegvégződések,
- fa-alakú elágazódás , amely főleg a lazarostos kötőszövetben található mechanoreceptor,
- gomolyok , melyek az érrendszer specifikus kémiai receptorai (kemoreceptorok),
- Golgi-féle ínorsó , az izom, ínba való folytatásánál található mechanoreceptor,
-
idegvégtestek,
- Krause-féle végtest , korábban hidegérzékeny receptornak tartották, ma a bőr és a zsigerek falának mechanoreceptorai állítást tartják a leginkább megfelelőnek, ezekhez hasonló végződések találhatók a nemi szervek erogén zónáin (pl.: makk),
- Vater-Pacini-féle idegvégtest , a bőrben, ízületekben, sőt egyes zsigeri szervekben (pl. hasnyálmirigy) találhatók, melyek nyomásra és vibrációra érzékenyek.
C/ Az izomszövet idegvégződései:
-
érzővégződés,
- izomorsó , ami a vázizomszövet ún. önérző receptora „proprioceptor”, melyek az izmok kontrakciós állapotát detektálják, szerepe a vázizomreflexek (részletesebben lásd 3.4. fejezet) kivitelezésében van,
-
mozgató
- minden vázizomrostnak van motoros beidegzése (lásd ideg-izom kapcsolat),
- simaizomszövet beidegzése: vegetatív alapfonadék, gyöngyfűzérszerű megvastagodásokkal (varikozitások)
D/ Az idegszövet idegvégződései:
A szinapszisok
Szinapszis nak nevezzük azt a helyet, ahol az idegsejtek kapcsolódnak, kommunikálnak egymással. Szinapszisok általában az egyik idegsejt axonja, illetve a másik idegsejt dendritje (axo-dentritikus), sejtteste (axo-szomatikus), vagy axonja (axo-axonikus) között alakulnak ki.. A neuronok közötti kapcsolatokat - természeti jellegük alapján – két kategóriába sorolhatjuk. Ennek alapján elektromos-, és kémiai szinapszisról beszélhetünk.
2.6.2. Az elektromos szinapszis (gap junction)
Elnevezése onnan adódik, hogy rajta az ingerület elektromos úton, sebesen és akadálytalanul megszakítás nélkül, terjedhet egyik neuronális membránról a másik membránra. Az elektromos szinapszis esetén az ingerátadás többnyire kétirányú folyamat. Ebbe a kategóriába tartozó szinapszisok megjelenési formája az ún. réskapcsolat, gap junction (2-7. ábra). A név onnan származik, hogy a két kapcsolatban részt vevő membránok között csak egy nagyon kismértékű távolság (2-4nm) figyelhető meg. A réskapcsolatokon kismolekulájú anyagok (aminosavak, cukrok) akadálytalanul juthatnak át. Kísérletek igazolták, hogy az alkohol gátolja az elektromos szinapszisok működését. Napjainkban a központi idegrendszer egyre több területén (gerincvelő, kisagy, retina) mutatnak ki elektromos szinapszist, melyek jelentős szerepet játszanak e szinapszisok információfeldolgozásban betöltött feladataik kiderítésében.

2-7. ábra: Elektromos szinapszis elektronmikroszkópos felvétele egér agykéregből
D: dendrit, nyilak: elektromos szinapszis. Aránymérce: 200 µm
2.6.3. Kémiai szinapszisok
Ebbe a kategóriába tartozó szinapszisokat is két különböző csoportba oszthatjuk, úgymint:
- valódi kémiai szinapszisok
- nem valódi kémiai szinapszisok
2.6.4. A valódi kémiai szinapszisok
A szinapszis területét három fő egységre lehet felosztani. Megkülönböztetünk szinapszis előtti membránfelszínt (preszinaptikus membrán),szinapszis utáni membránfelszínt (posztszinaptikus membrán), ill. az ezek között található, az elektromos szinapszisnál jóval nagyobb szinaptikus rést (20-40nm).
Az akciós potenciál az előbbi fejezetben tárgyalt módon (ingerület terjedése) eljut az idegsejt végéhez, a szinaptikus végfácskához, ahol az ingerület továbbítása ingerületátvivő anyagok (neurotranszmitterek) közvetítésével valósul meg. Az ún. „klasszikus neurotranszmitterek”, mint pl.: acetilkolin, glutaminsav, glicin, gamma-amino-vajsav (GABA), katecholaminok, hisztamin, szerotonin olyan kis tömegű molekulák, melyek az idegvégződésekben szintetizálódnak. A klasszikus transzmitterek receptorai két csoportba sorolhatók. Az ionotróp receptorok (pl. ideg-izom szinapszis receptora) önmaguk egy ioncsatornát alkotnak, melyek a transzmitter megkötődése után nyílnak. A másik családba a metabotróp receptorok (pl.: GABAB) tartoznak, melyek nem tartalmaznak ioncsatornát, a neurotranszmitter speciális sejten belüli folyamatokat indít be.
A transzmitterek másik típusát a neuropeptidek alkotják, Ide sorolhatók egyebek között az endorfinok, enkefalinok, P-anyag, bombezin, VIP, gasztrin, NPY, valamint a kolecisztokinin egyaránt. A fent említett két típusnak az a közös jellemzője, hogy az idegvégződésekben szinaptikus vezikulákban tárolódnak.
*Kiegészítés: A vezikulákban töténő tárolást gyógyszerek, illetve különböző kémiai anyagok befolyásolhatják. Pszichostimulánsként alkalmazott drogok, mint az amfetamin és az ’ecstasy’ kiüríti az amin tartalmú vezikulákat.
A harmadik típusba olyan neurotranszmitterek tartoznak, melyek rövid életidejű, kis molekulák (nitrogén-monoxid (NO), illetve szén-monoxid (CO)), közvetlenül a felszabadulásuk előtt keletkeznek, vezikulákban nem tárolódnak.
Akciós potenciál hatására a szinaptikus hólyagocska (vezikula) - melyben az ingerületátvivő anyag található – a preszinaptikus membránhoz vándorol, és tartalmát a szinaptikus résbe üríti (exocitózis). A transzmitterek felszabadulásának alapvető feltétele, hogy a sejten kívüli térből Ca 2+-ion áramoljon a sejten belülre. A szinaptikus résbe juttatott ingerületátvivő anyagok diffúzióval, a nagyobb koncentrációjú helyről (preszinaptikus membrán), a kisebb koncentrációjú helyre (posztszinaptikus membrán) vándorolnak, ahol specifikus receptorokhoz kapcsolódnak. A receptorhoz kötött transzmitter hatására megváltozik a posztszinaptikus membrán állapota (2-8. ábra).
Az ingerületátvivő anyagok hatásai alapján két csoportra oszthatjuk a szinaptikus kapcsolatokat. Beszélhetünk serkentő és gátló szinapszisokról.
Serkentő szinapszis
Ennél a típusnál az ingerületátvivő anyag lehet, pl. acetilkolin, noradrenalin vagy glutaminsav. Ha a posztszinaptikus membránban levő receptor megkötötte a transzmittert, kinyílik az ioncsatorna, és Na+-ion vándorol a posztszinaptikus membránon keresztül a sejt belseje felé, megváltoztatva annak töltésviszonyait. A posztszinaptikus membránon úgynevezett excitatórikus posztszinaptikus potenciálváltozás (EPSP) alakul ki. A keletkezett elektromos impulzust a membrán tovább vezeti, végül a posztszinaptikus sejten több akciós potenciál alakul ki. A preszinaptikus membránról kiinduló, és a posztszinaptikus membránban keletkezett potenciálváltozás között eltelt idő a szinaptikus késés, mely ember esetében 0,5ms körüli érték.
Gátló szinapszis
A szinapszisok e típusánál az ingerületátvivő anyag pl. a GABA (gamma-amino-vajsav), vagy a glicin. Ezek a neurotranszmitterek a posztszinaptikus membrán receptoraihoz kapcsolódnak, melynek hatására a membrán Cl--iont ereszt át. A Cl--ionok hatására nő a negatív töltések aránya a sejten belül, a membrán hiperpolarizálódik, inhibitoros posztszinaptikus potenciálváltozás (IPSP) jön létre.
*Kiegészítés: Egyes neurotranszmitterek (dopamin, noradrenalin, szerotonin) serkentő és gátló hatásúak is lehetnek. Ha bizonyos agyterületeken csökken a fent említett neurotranszmitterek mennyisége, hangulatingadozások, depresszió alakulhat ki.
A kialakult EPSP-k és IPSP-k térben és időben szummálódnak, majd kizárólag az idegsejt axondombján (csak ott találhatók feszültségfüggő Na+ -csatornák) a potenciálváltozásnak megfelelően (a minden vagy semmi törvény szerint) akciós potenciál keletkezhet.
Korábban említettük, hogy minden vázizomrostban motoros idegvégződéseket találhatunk. Az alábbiakban ezekkel a speciális végződésekkel, az ideg-izom kapcsolatokkal foglalkozunk részletesebben.
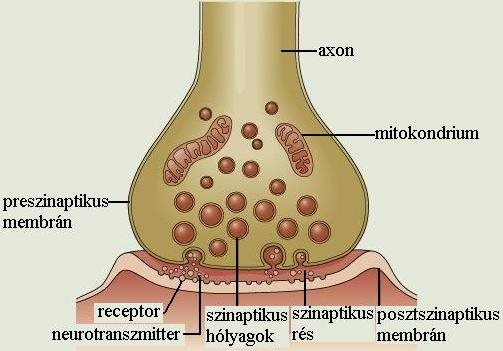
2-8. ábra: A valódi kémiai szinapszis működése
2.6.5. Az ideg-izom kapcsolat (neuromuszkuláris junkció)
Gerinces szervezetek vázizmai a központi idegrendszerből hozzájuk futó idegrostok impulzusainak hatására húzódnak össze. Az idegrostokban keletkezett AP áttevődése az izomrostokra egy speciális nem valódi kémiai szinapszisban, az ideg-izom szinapszisban történik (2-9. ábra). Ilyen szinapszis a vázizomszövet és az izomrost érintkezési területe, a motoros véglemez.
A neuromuszkuláris junkció felépítése
A harántcsíkolt izmokhoz futó axonok a gerincvelő elülső szarvából (lásd. 3.1. fejezet) származó motoros neuronok. Egyetlen axon által beidegzett izomrostokat motoros egységnek nevezzük. A vastag velőhüvelyes axon, mely Aa típusú motoneuron (ld. 2-1.táblázat), a vázizomrostok közvetlen közelében elveszti velőhüvelyét, elágazódik és a motoros véglemez preszinaptikus részét képezi. A végfácskában vezikulák találhatók, melyek tartalmazzák a neuromuszkuláris junkció transzmitterét, az acetilkolint. A csupasz axonon számos kiöblösödést találunk, melyek benyomulnak az izomrost szarkolemmája által kialakított mélyedésekbe. A preszinaptikus rész és a szarkolemma között található ajunkcionális rés, melynek vastagsága körülbelül 40-60nm. A szarkolemma által kialakított részen, a posztszinaptikus membránon ujjszerű kitüremkedéseket, ún. junkcionális redőket figyelhetünk meg. Ezekben a redőkben helyezkednek el az ionotróp receptorcsaládba tartozó, nikotin-típusú acetilkolin receptorok (nAChR).
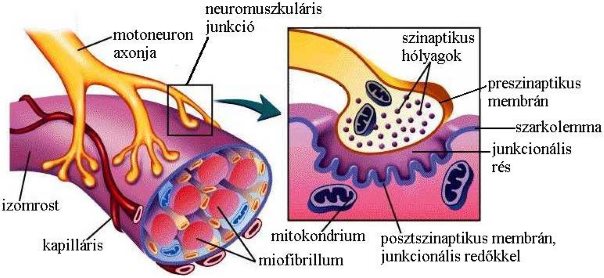
2-9. ábra: A neuromuszkuláris junkció szerkezete
A neuromuszkuláris junkció működése
Az axonon keletkezett AP hatására megnyílnak a preszinaptikus végződés Ca2+-csatornái, ionbeáramlás történik a sejtbe, melyet a végződésben található vezikulák szinaptikus résbe való exocitózisa követ. Egy-egy akciós potenciál több száz vezikula ürülését eredményezheti. A szinaptikus résbe jutó ACh diffúzióval a posztszinaptikus membránhoz kerül, majd a saját specifikus receptorához, a nAChR-hoz kapcsolódik. A transzmitter megkötése után a receptor ioncsatornaként működik, melyen át Na+-ionok áramlanak a szinaptikus résből a posztszinaptikus membránon keresztül a sejtbe (2-10. ábra). A Na+ beáramlás következtében az izomrost depolarizálódik, akciós potenciál alakul ki, melyet az izom összehúzódása követ (lásd 1.6. fejezet). A szinaptikus résbe került ACh molekulákat az acetilkolin-észteráz nevű enzim hatástalanítja.
*Kiegészítés: 1.) A Clostridium botulinum nevű baktérium toxinja, a botulinumtoxin (Botox) gátolja az ACh-t tartalmazó vezikulák szinaptikus résbe történő exocitózisát. A mérgezést követően a vázizomzat bénulásos tünetei figyelhetők meg. 2.) A dél-amerikai indiánok nyílméreg hatóanyaga, a kuráre a nAChR-hoz kapcsolódva gátolja az ACh molekulák kötődését. 3.) Mérgező harcigázok gátolják az acetilkolin-észteráz működését, ezáltal az ACh lebomlását.
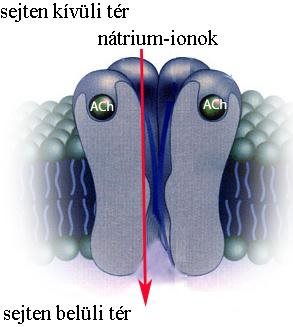
2-10. ábra: A nikotin-típusú acetilkolin receptor működése
| « Előző fejezet | Tartalomjegyzék | Következő fejezet » |
Események
Jelenleg nincs aktuális esemény.

















