TÁMOP-4.1.2.E-13/1/KONV-2013-0012
"Sporttudományi képzés fejlesztése
a Dunántúlon"
- -> Tananyagfejlesztés
- -> A vázizom...
- -> 2.
2.
2. A VÁZIZOM ANATÓMIAI FELÉPÍTÉSE
- 2.1. Az izomrostok születése és kifejlődése
- 2.2. A neuromuszkuláris szinapszis kialakulása
- 2.3. Az izomrost típusok kialakulása
- 2.4. A vázizom szerkezete
- 2.4.1. A vázizom passzív része: a kötőszövet
- 2.4.2. A vázizom aktív része: az izomrost
- 2.4.3. Az izomrost funkcionális egysége: a szarkomer
- 2.4.4. A szarkomer szerkezeti fehérjéi
- 2.4.5. A „csúszófilamentum” mechanizmus
- 2.4.6. Kontraktilis és elasztikus izomrészek kölcsönhatása: a háromelemes modell
- 2.4.7. Az izom hossza és keresztmetszete
2.1. Az izomrostok születése és kifejlődése
Az izomsejtek (muscle cell), vagy más néven izomrostok (muscle fiber) születését és fejlődését myogenézisnek nevezzük (2.1. ábra). Az embrió gerinchúrjában található őssejtekből indul a folyamat. Az őssejtek (stem cells) a megfelelő kémiai jel hatására bármilyen szövetre jellemző sejtté átalakulhatnak (differenciálódnak). Az izomszövet esetében két fehérje indítja el a folyamatot, a myoD és a myf5 (Edmonson és Olson, 1989; Scales és mtsai, 1990). Ezeknek a fehérjéknek a hatására az őssejtek myoblasztokká alakulnak, melyek primitív, egy sejtmaggal rendelkező (mononukleotid) izomsejtek. Ezt követően a myoblasztok egymással tömörülve myotubulusokat formálnak, melyek már hosszabb sejtképződmények, és mivel minden myoblasztnak van sejtmagja, így a myotubulus már több sejtmaggal rendelkezik. A myotubulusok még nem olyan hosszúak, mint a kifejlődött izomrostok, így azok végeihez még további myoblasztok kapcsolódnak. A myotubulusok hosszirányú fejlődése már a kifejlett izom funkciójára, vagyis a rövidülésre és nyúlásra utal. A myotubulusok további vastagodáson mennek keresztül, míg végül érett izomrosttá fejlődnek. A fejlődés végére jellemző, hogy a rostok sejtmagjai a központi elhelyezkedés helyett a sejt felszínére orientálódnak. A sok sejtmagúság különös tulajdonsága az izomnak, mely lehetővé teszi azt, hogy az izomrost elszakadásakor a leszakadt részek, melyekben van sejtmag, életképesek maradjanak. A teljesen kifejlett izomban is maradnak be nem épült myoblasztok. Ezeket szatellit sejteknek nevezzük és nagyon fontos szerepet töltenek be az izomsérülés utáni regenerációban, ugyanis ezek a sejtek beépülnek a „meghibásodott” izomrostokba és normál izomrostokká alakulnak át.
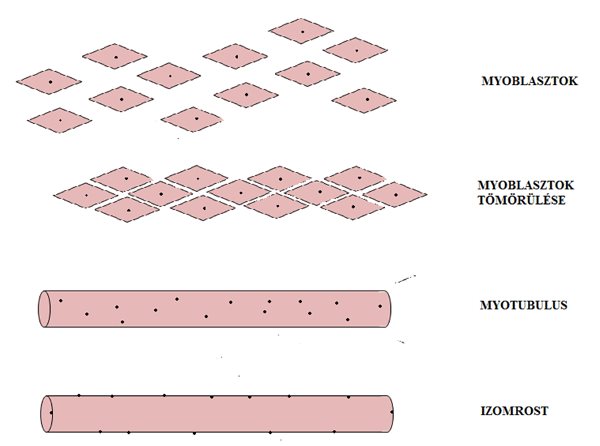
2.1 ábra. Az izomrostok születése
2.2. A neuromuszkuláris szinapszis kialakulása
Az izomrostok kifejlődésekor a rostokat körbevevő sejtmembrán (szarkolemma) felszínén acetilkolin (ACh) receptorok találhatók egyenletesen elosztva. Az ACh-nak az idegsejtről (neuron) az izomsejtre történő elektromos ingerület-átvitelben van szerepe. Amikor a mozgató idegsejtek nyúlványai megtalálják az izomrostokat, hozzájuk kapcsolódnak. A mozgató idegsejt (motoneuron) nyúlványának (axon) izommal létesített kapcsolatát neuromuszkuláris szinapszisnak (neuromuscular junction), vagy motoros véglemeznek nevezzük (motor endplate). A kapcsolódás után az ACh receptorok a kapcsolódás helyére vándorolnak (Poo, 1982), és ezzel megakadályozzák, hogy az izomrost más területén is kialakulhasson szinapszis. Érdekes, hogy az embrióban még egy izomrost ugyanazon pontjához több motoneuron axonja is kapcsolódhat, melyre még nem találtak magyarázatot a kutatók. A születést követően azonban ezek száma csökken és végül minden rostot egy motoneuron fog beidegezni (elimináció).
2.3. Az izomrost típusok kialakulása
A humán vázizom lassú és gyors rángású izomrostokat keverten tartalmaz. Ezek a rostok különböző feladatokat látnak el attól függően, hogy az adott feladat hosszantartó, vagy pedig rövid idejű, gyors és erőteljes izomkontrakciókat igényel. Buller és mtsai (1960) úgynevezett kereszt-innervációs kísérletükkel bebizonyították, hogy a motoneuron határozza meg azt, hogy egy izomrost lassú vagy gyors típusú lesz. A kísérlet során a gyors és lassú rostokhoz tartozó axonokat levágták és keresztezték, és ennek eredményeképpen a gyors rostból lassú, a lassú rostból pedig gyors rost lett. Ugyanakkor Miller és Stockdale (1986) igazolták, hogy már az éretlen myoblasztoknak is van lassú és gyors típusuk, és az azonos típusúak tömörülnek össze myotubulust és később érett rostot alkotva. Akkor mégis hogyan találja meg az axon a megfelelő rostot? Három lehetséges módja van: 1. az axon már a fejlődés elején megtalálja a megfelelő izomrostot, 2. az axon rossz izomrosthoz kapcsolódik és megváltoztatja annak típusát, 3. vagy a már korábban említett módon az embrionális időszakban több axon is beidegez egy rostot, majd az elimináció során csak a megfelelő marad meg és fogja alkotni a szinapszist. A tudomány jelenlegi állása szerint az első elmélet bizonyul a legvalószínűbbnek (Thompson és mtsai, 1984).
2.4. A vázizom szerkezete
2.4.1. A vázizom passzív része: a kötőszövet
A teljes izom passzív és aktív izomrészekből áll. A passzív részeknek nevezzük a kollagén és elasztin fehérjéket tartalmazól kötöszöveti részeket, amelyek nem képesek akaratlagosan erőt kifejteni (ezért alkalmazzuk a „passzív” kifejezést), bár a későbbiekben tárgyalni fogjuk, hogy ennek ellenére nagyon fontos szerepük van a mozgásokban. Ha az izmot a nagyobb alkotórészektől a kisebbek felé haladva vizsgáljuk meg (2.2 ábra), akkor először a teljes izmot körbevevő legvastagabb kötőszövettel találkozunk, ez az epimysium. Az epimysium választja el egymástól a különálló izmokat. Az izom belseje felé haladva találjuk perimysium nevű kötőszöveti részt, mely vékonyabb, mint az epimysium, de ennek ellenére igen ellenálló. A perimysium választja szét az izmot izomkötegekre (fascicula), így utat biztosítva az izomhoz tartó vérereknek és idegeknek. A legkisebb kötőszöveti egység az endomysium, mely minden egyes izomrostot körbevesz. Az endomysium, melynek vastagsága mintegy tizede az epimysiuménak, biztosítja a helyet az izomrostokhoz érkező kapillárisoknak.
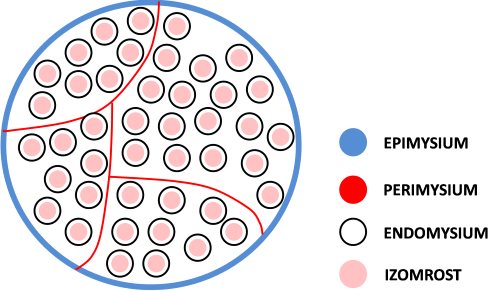
2.2. ábra. A teljes izom kötőszöveti felépítése.
A vázizom kötőszövete négy nagyon fontos funkciót lát el:
- Biztosítja a helyet az izmokhoz futó idegeknek és vérereknek, hogy azok akadálytalanul jussanak el az izom belsejéig.
- Stabilan összefogja, összetartja a vékony és hosszú izomrostokat, ezáltal biztosítva azt, hogy a kontrakció során az izomrostok azonos irányba fejtsenek ki erőt.
- Fontos szerepük van az erő közvetítésében, hiszen az izomrostok által akaratlagosan kifejtett erő erre a kötőszövetre tevődik át, és a kötőszövet az izom két végpontjánál található ínban összpontosul. Az inak maguk is kötőszövetből állnak, rendkívül erős képződmények, melyek az izmokat a csontokkal kötik össze. Ha elképzeljük, hogy egyes sportolók mekkora erőt képesek kifejteni, megértjük, hogy a kötőszövet micsoda teherbírásra képes.
- Nagymértékben ellenáll a nyújtásnak, megvédve az általuk körbezárt izomrostokat. Rugalmas (elasztikus) tulajdonsággal bír. Ez az elaszticitás kifejezetten fontos egyes ciklikus emberi mozgásoknál (járás, futás, sorozatugrások), ugyanis a megnyújtott kötőszövet energiát képes raktározni, és a nyúlás alatt raktározott elasztikus energia az izom összehúzódásakor hozzáadódik az izomrostok által kifejtett erőhöz, segítve a külső ellenállás legyőzését.
Ha a kötőszövet és az izomrostok anatómiai elrendezését megfigyeljük, akkor egyértelműen látszik, hogy bár az izom lágy részekből álló szövet, a csontokra mégis igen nagy erőhatást képesek kifejteni. A szöveti elrendezettség olyan módon valósul meg, hogy a kisebb izomegységek részereje összeadódjon, és így együttesen nagy külső ellenállások legyőzésére legyen alkalmas.
2.4.2. A vázizom aktív része: az izomrost
A kötőszövet által körbevett izomrészek az akaratlagos erőkifejtésért felelősek. Az izomrost az erőkifejtés egysége, ezért ezeket az izom aktív részeinek tekintjük. Az izomrost egy henger alakú sejt, mely egészséges felnőtt embernél 10-100 µm átmérőjű, és 2-3 cm-től kezdve akár 45 cm (m. sartorius) hosszú is lehet (Wickiewitcz és mtsai 1983). Ez az alakzat már önmagában hosszirányú működésre (összehúzódásra - elernyedésre - nyúlásra) enged következtetni. Az izomrost átmérője és hossza nagyon fontos meghatározója az emberi erőkifejtésnek. Az átmérő ugyanis a kontrakció erejét befolyásolja, és az átmérő csökkenése inaktivitásra, növekedése pedig edzettségre utal. Minél nagyobb az izomrost átmérője, annál nagyobb az erőkifejtő képessége. A rostok hossza az összehúzódás sebességét befolyásolja, ugyanis minél hosszabb egy izomrost, annál nagyobb rövidülési sebesség elérésére lehet képes. Ezeknek a mechanizmusoknak a megértése csak akkor válik teljessé, ha megismerjük az izomrost molekuláris összetevőit és a kontrakció molekuláris mechanizmusát.
Az izomrostok szorosan egymás mellett helyezkednek el, és az endomysium választja el őket egymástól (2.2. ábra). Az izomrostok nagyon ritka esetben futnak az eredési íntól a tapadási ínig, tehát legtöbb esetben jóval rövidebbek, mint maga a teljes izom hossza. Az endomysium, amely egy mátrix-szerű kötőszövet képződményként, minden rostot körbevesz és biztosítja azt, hogy az erő rostról-rostra áttevődjön és végezetül az inakhoz érjen (Ounjian és mtsai 1991). Ez nagyon fontos tulajdonság, mert a hajszálvékony izomrostok önmagukban nagyon kicsi erőkifejtésre képesek, nagy ellenállást csak együttes erővel képesek legyőzni. Az izom hasában található izomrostok tehát erőt fejtenek ki, az erő a kötőszövet által az ínvégekre tevődik, és az inak mozdítják el a csontokat úgy, hogy a tapadás helyére fejtenek ki erőt.
Mint minden más sejt, az izomrost is rendelkezik sejtmembránnal (szarkolemma). A szarkolemma (2.3. ábra), azon kívül, hogy a sejt organikus részeit a sejten belül tartja, fontos szerepet tölt be a kontrakcióban. A mozgató idegsejtek axonjain érkező elektromos ingerületet, vagy impulzust (akciós potenciált) ugyanis a szarkolemma képes tovább vezetni és az egész izomrost felületén szétterjeszteni. A szarkolemma az izomrost bizonyos helyein mélyen betüremkedik az izomrost belsejébe, hogy az akciós potenciálokat oda is bevezesse. Ezeket az izomrost felszínére merőleges betüremkedéseket transzverzális tubulusoknak (T tubulus) nevezzük. Az izom mélyére bejutó elektromos inger lesz a kontrakciót kiváltó kulcs. Az izomrost belső részét, melyet a szarkolemma határol szarkoplazmának nevezzük.
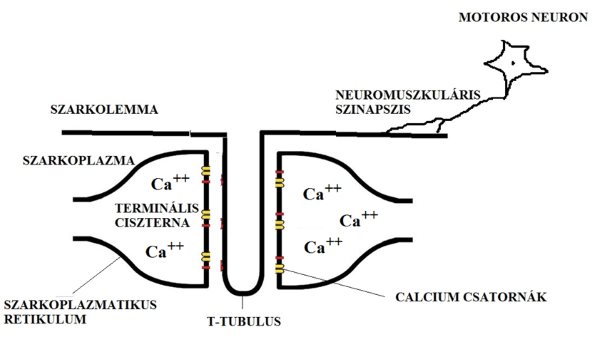
2.3. ábra. Az izomrost ingerületvezetési rendszere.
Az izomrost mélyén hosszanti irányú csatornákkal is találkozunk, ezeket szarkoplazmatikus retikulumnak nevezzük. A szarkoplazmatikus retikulum hosszanti és a T tubulus erre merőleges irányából adódik, hogy a két csatornának valahol egymást kereszteznie kell. A felszíntől az izomrost mélyére hatoló T tubulus mintegy kettészeli a szarkoplazmatikus retikulumot, megszakítva annak folytonosságát. A megszakítások helyén található tehát egy T tubulus, és annak két oldalán elhelyezkedő szarkoplazmatikus retikulumok. A három képződményt együttesen triádnak nevezzük. A triádokban elhelyezkedő szarkoplazmatikus retikulum végeket terminális ciszternáknak nevezzük. A T tubulusokon érkező akciós potenciál átterjed a terminális ciszternákra és ennek következtében a szarkoplazmatikus retikulumban tárolt Ca2+ ionok kiszabadulnak, létrehozva az izomkontrakciót. Az inger szétterjedésének és az általa létrehozott kontrakciónak a részletes mechanizmusát később tárgyaljuk.
Mint ahogyan azt már korábban említettük, minden egyes izomrost önálló (de egyetlen) beidegzéssel rendelkezik. Ha a beidegző axonon keresztül inger érkezik a rosthoz, akkor az egész rost kontrakcióval fog válaszolni. A rostokat körülvevő endomysium megakadályozza azt, hogy a szomszédos rostokra is ráterjedjen az ingerület. Ezt egyfajta elektromos szigetelésnek is felfoghatjuk. Így tehát az egyes rostok elkülönítve is működtethetők, és az idegrendszer vezérli azt, hogy az egyes izomrostok bekapcsolódnak az erőkifejtésbe vagy nem. Ez a feladat nehézségén múlik. Amennyiben nagy erőt kell kifejteni, a rendelkezésre álló izomrostok nagy része be fog kapcsolódni.
Az izomrostra jellemző, hogy több sejtmaggal is rendelkezik. A sejtmagok az izomrost teljes hosszában, annak felszínén helyezkednek el, viszont a motoros véglemez környékén sűrűbben találhatók. A sejtmag kromoszómáinak génjei irányítják az izomrostban a fehérjeszintézist. Az izomrost egy másik fontos alkotórésze a mitokondrium (mytochondria). A mitokondriumban kerül előállításra a nagy energiával rendelkező adenozin trifoszfát (ATP), amely az izom egyetlen közvetlen energiaforrása, bár ATP-t mindhárom tápanyagforrásból (szénhidrát, zsír, fehérje) elő lehet állítani. Az ATP nélkülözhetetlen szerepet tölt be a kontrakció molekuláris mechanizmusában.
Az izom hosszirányú felépítettsége az izomroston belül is megfigyelhető. Az izomrostok kisebb egységei a myofibrillumok (myofibrills) (2.4. ábra). A myofibrillumok mintegy 1-2 mm átmérővel rendelkeznek, és az izom mélyére hatoló tubuláris rendszer választja el azokat el egymástól. Minden egyes myofibrillumot T-tubulus vesz körbe, biztosítva ezáltal azt, hogy a rost felszínéről érkező akciós potenciálok (elektromos ingerek) az izom minden részére eljuthassanak. Ha a myofibrillumokat további részekre tagoljuk, akkor eljutunk az vázizom legkisebb egységeihez, a myofilamentumokhoz (myofilament). A myofilamentumok olyan óriásmolekulák, melyek magáért a kontrakcióért felelősek. Kétféle myofilamentum létezik: az aktin tartalmú vékony filamentum és a miozin tartalmú vastag filamentum. A myofibrillumok keresztmetszetét vizsgálva megfigyelhető, hogy a myofilamentumok hexagonálisan helyezkednek el úgy, hogy minden egyes miozint hat aktin molekula vesz körbe egyenlő távolságra a miozintól. Az aktin és a miozin molekulák nem futnak végig a myofibrillum teljes hosszán, hanem szakaszokban találhatók meg. A myofibrillumban vannak olyan szakaszok, ahol csak aktin, csak miozin, vagy pedig mindkét molekula megtalálható. E miatt az elrendeződés miatt hosszmetszetben a myofibrillumok és az egész izomrost elektronmikroszkóp alatt egymásután váltakozó világos és sötét csíkokat mutat. Innen ered a „harántcsíkolt” kifejezés. A vastag és vékony filamentumok között kereszthidak létesülhetnek, melynek következtében a két molekula elcsúszik egymáson, létrehozva az izom rövidülését.
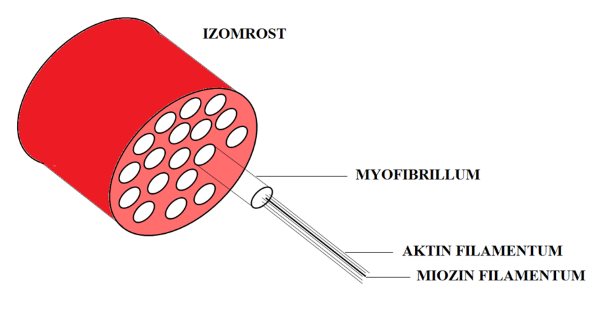
2.4. ábra. Az izomrost szerkezeti felépítése.
A miozin az izom szerkezetében az egyik legfontosabb molekula, mert az izomerő kifejtésének mértékét és sebességét szabályozza. Egy miozin molekula egy hosszabb, kettős helikális szerkezetű farki részből (myosin tail) és a hozzá tartozó két fejből (myosin head) áll (2.5. ábra). A farki részen található egy törés (hinge region), amely mentén az egész molekula hajlékonnyá válik. Ez a hajlékonyság szükséges ahhoz, hogy a miozinfejek az aktinhoz közelítsenek a kereszthidak kialakításáért. A miozin fejet S1 szegmensnek is szokták nevezni. Egy miozin molekula (ha két helikális szerkezetű molekulából álló farki részt és a két fejet együttesen vesszük figyelembe) két nehéz és négy könnyű fehérjeláncból áll. A miozin nehéz lánc (myosin heavy chain) az egész miozin molekulán végighúzódik, tulajdonképpen a teljes farki és feji részt ez alkotja. A könnyű láncok (myosin light chain) a miozin fej nyaki részén találhatók (2.5. ábra). A feji rész három szegmensből tevődik össze (50KD, 25KD és 20KD molekula súlyú szegmens) (2.5. ábra), melyek közül a legkisebbhez (ami egyébként a miozinfej nyaki része) kapcsolódnak a könnyű láncok. A nagyobbik szegmens felelős az aktinkötésért illetve kontrakcióhoz szükséges ATP hidrolizálásáért. Ezt a szegmenset teljes egészében kettéválasztja egy hasadék, melynek szélességét az ATP szabályozza (Rayment és mtsai 1993). Ha ugyanis az ATP behatol a hasadékba, az 50KD szegmens alsó és felső része eltávolodik, és ennek következtében az aktin-miozin kötés gyengül. A hasadék bezáródásával pedig erősödik az aktin-miozin kötés. Fontos megjegyeznünk, hogy a hasadék kinyílása a miozinfej elfordulását is eredményezi. A miozin molekula egyes alkotórészeinek szabályozó szerepét a későbbiekben tárgyaljuk.
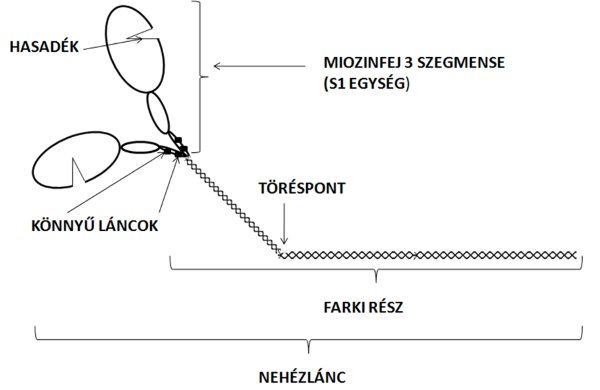
2.5. ábra. A miozin molekula szerkezeti felépítése.
Kontrakció során a miozin fej tapad hozzá az aktinhoz a kereszthidat alkotva és a fej elmozdulása okozza az erőkifejtést (power stroke). Több miozin molekula egymásra csavarodva alkotja a miozin filamentumot (vastag filamentum). Az összecsavarodás olyan módon történik, hogy keresztmetszetéti nézetből a fejek egymástól 60°-al elfordulva helyezkednek el, hosszmetszeti nézetből pedig 1-2 nm-re egymástól elcsúszva (2.6. ábra). A miozin fejek ilyen térbeli elrendeződése lehetővé teszi, hogy minél több kereszthíd létesülhessen az aktin és miozin között, jelentősen növelve a teljes izom erőkifejtési kapacitását.

2.6. ábra. A miozin molekulák hosszbeli elrendeződése.
Az aktin filamentum (vékony filamentum), mely helikális szerkezetű és egy kettős gyöngysorra emlékeztet, aktin monomerekből tevődik össze. Míg a vastag filamentumok csupán miozinból állnak, a vékony filamentumok az aktinon kívül más fehérjéket is tartalmaznak, melyek a kontrakció szabályozásáért felelnek. Az aktin gyöngysorára csavarodik a tropomiozin nevű molekula, azon pedig azonos távolságokra egymástól egy-egy troponin molekula található (2.7. ábra). A troponin felelős a kontrakció indításáért, vagyis a kereszthíd létesítéséért. A troponin három alegységből áll:troponin T, amely a troponint a tropomiozinhoz köti, troponin C, amelyhez a kontrakció során a kalcium ion kapcsolódik, és troponin I, mely meggátolja a kontrakciót, amennyiben nincs jelen kalcium. Ezeknek a fehérjéknek a kontrakciót szabályozó szerepét is a későbbiekben tárgyaljuk.
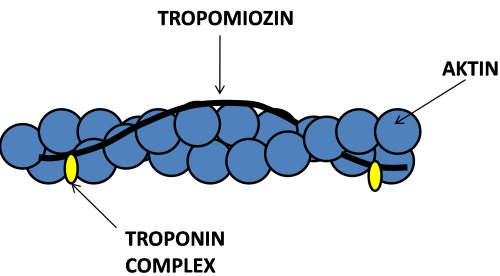
2.7. ábra. Az aktin filamentum szerkezeti felépítése.
2.4.3. Az izomrost funkcionális egysége: a szarkomer
Ha a myofibrillum hengeres alakjától eltekintünk, és elektronmikroszkóp alatt csak hosszmetszetében vizsgáljuk azt, akkor látható, hogy a harántcsíkolatok alapján elkülönített szakaszok ismétlődnek. A myofibrillumokban az ismétlődő szakaszokat szarkomernek nevezzük, és az izom funkcionális egységének tekintjük. Ha a szarkomert elektronmikroszkóppal vizsgáljuk, akkor jól látható, hogy a már említett aktin és miozin filamentumok egymással párhuzamosan helyezkednek el, és azok, mint a fésűfogak összefonódnak (2.8. ábra). A szarkomer két szélén vannak olyan részek, amelyek a harántcsíkolat világos részét képezik, ugyanis itt csak a vékony aktin filamentum található meg. Ezt nevezzük I csíknak. A szarkomer középső része sötétebb, itt ugyanis mind a vékony aktin, mind pedig a vastag miozin molekula megtalálható, egymást átfedve. Ezt A csíknak nevezzük. Az A csíkon belül is található még egy vékonyabb világos sáv, de itt csak a miozin molekulák találhatók meg, ezt H zónának nevezzük.
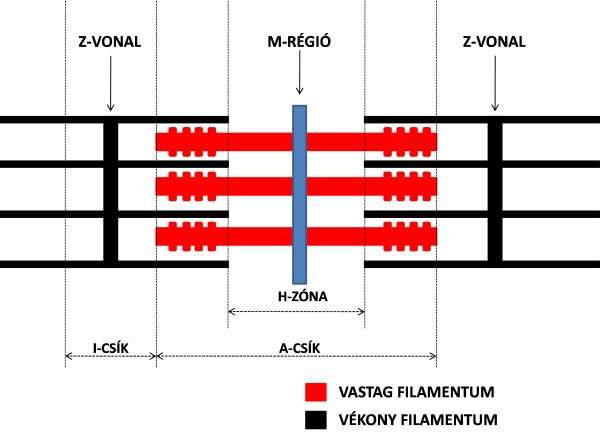
2.8. ábra. A szarkomer szerkezete.
2.4.4. A szarkomer szerkezeti fehérjéi
Az aktin és miozin filamentumok szabályos elrendeződéséért, valamint a kontrakció során a rendezettség megtartásáért számos fehérje felel. A filamentumok fő rögzítő helyei az M-zóna, illetve a Z-vonal (vagy Z-lemez) (2.8. ábra).
A miozin filamentumokat összetartó fehérjék egy része a H zónán belül vékony, úgynevezett M vonalakban strukturálódnak, amelyeket együttesen nevezünk M-zónának. Az M-zóna fehérjéi tartják meg a miozin molekulák integrált szerkezetét, hogy azok ne essenek szét egymástól. Ezek közül a fehérjék közül az egyik a kreatin kináz (CK), mely köztudottan intenzív edzést követően leszakadhat és bekerülhet a véráramlásba. A CK az egyik leggyakrabban mért mikrosérülés mutató a sportorvosok és élsportolók körében. A másik jól ismert, M-zónát összetartó fehérje a myomesin. Az M zóna fehérjéit M-filamentumoknak is nevezik.
A miozin végeket a titin molekula rögzíti a Z-vonalhoz. Ebben a „kifeszített” állapotban a miozin filamentumok megtartják rendezettségüket, egymástól való távolságukat. A titin egy óriásmolekula, amely a nyugalmi hosszának akár négyszeresére is nyúlhat. Immunglobulin alegységekből épül fel, melyek harmonikaszerűen képesek össze- és széthajtódni. Az inak mellett részben a titin molekuláknak is tulajdonítható az izom passzív rugalmassága. Egyes szerzők a titint „molekuláris rugónak” is nevezik (Erickson, 1997; Keller,1997). Az izom passzív nyújtásakor ezek a molekulák egyre nagyobb ellenállást tanúsítanak, majd a nyújtás befejezésével visszarendeződnek eredeti hosszukra.
A Z-vonal α-aktinin nevű fehérjéje rögzíti egymáshoz a Z-vonal egyik illetve másik oldalán elhelyezkedő aktin filamentumokat. A Z-vonal további fehérjéi, a dezmin, a vimentin és a szinemin mintegy átszövik és rögzítik a Z-vonalból kiinduló filamentumokat. A vékony aktinszálak térbeli szerkezetének megtartásáért a nebulin molekula felel, amely az egész aktinon végigfutva stabilizálja annak helyzetét. A Z-vonal fehérjéi nemcsak az aktin molekulákat rögzítik egymáshoz, hanem az egész aktin rendszert rögzítik a citoszkeletális fehérjékhez.
A citoszkeleton olyan fehérjékből (filamentumokból) álló rendszer, amely a sejten belül (a citoplazmában) található. A citoszkeletális fehérjék felelnek egy adott izomsejten belül a miofibrillumok összetartásáért, rendezettségéért. Másik szerepük abban van, hogy miofibrillumokat a membárnhoz rögzítik. A citoszkeletont nem egy merev szerkezetnek kell elképzelnünk, hanem jelentős rugalmassággal bír. Ez logikus, hiszen kontrakció során a rostok alakja, hossza és lefutási szöge is változhat. A citoszkeletonnak ezt követnie kell, miközben azért a miofibrillumokat is egyben kell tartania. A legismertebb citoszkeletális fehérjék az aktin, a spektrin és a disztrofin.
Számos olyan génmutáció létezik, amelynek következtében az izom normál disztrofintartalma jelentősen lecsökken. Ezeknek a betegségeknek a gyűjtőneve a disztrofia (dystrophy). Az egyik ilyen betegség a Duchenne disztrofia (Duchenne muscle dystrophy, DMD). A DMD betegek izomzatában a disztrofin hiánya abnormális működéshez és folyamatos mikrosérülésekhez, izomrost elhaláshoz (nekrózis) vezet. A mikrosérülések bár egy ideig regenerálódnak, előbb-utóbb kimerítik a regenerációért felelős szatellit sejtek kapacitását, így a beteg egyre gyengébb és fáradékonyabb lesz. A betegség következtében az egyén először tolószékbe kényszerül, majd a 20-as vagy 30-as éveiben életét veszti.
2.4.5. A „csúszófilamentum” mechanizmus
Az izomkontrakció molekuláris mechanizmusának kutatásában mérföldkőnek tekinthető az a felfedezés, amelyet az elektronmikroszkóp megjelenése tett lehetővé, és amely szerint az izom rövidülése úgy jön létre, hogy az aktin és miozin filamentumok egymás mentén párhuzamosan, de ellentétes irányba elcsúsznak, anélkül, hogy maguk a filamentumok rövidülnének. A két filamentum elcsúszását a kereszthidakban kifejtett „erőcsapás”, vagyis a miozin fej elfordulása okozza. Az elcsúszás következtében a szarkomerek Z lemezei közelednek egymáshoz, vagyis a teljes izom rövidül (2.9. ábra). A jelenséget csúszófilamentum mechanizmusnak (sliding filament mechanism) nevezzük. A felfedezés érdekessége, hogy azt két egymástól független kutatócsoport, Huxley és Niedergerke (1954), valamint Huxley és Hanson (1954) tették egyidejűleg, és mindkét csoport eredményei a rangos Nature folyóirat ugyanazon számában jelent meg. További érdekesség, hogy mindkét kutatócsoportban volt egy Huxley vezetéknevű kutató, rokonsági kapcsolat azonban nem volt közöttük.
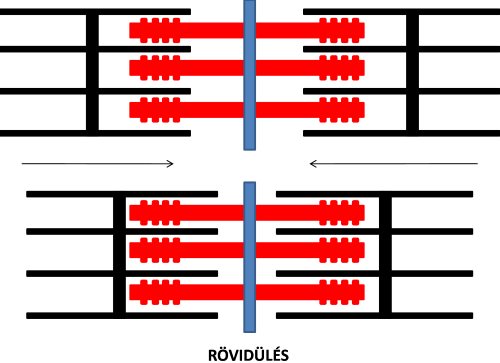
2.9. ábra. A szarkomerek rövidülése („csúszó filamentum” mechanizmus) Huxley és Niedergerke (1954), valamint Huxley és Hanson (1954) alapján.
Ahhoz, hogy az aktin és miozin filamentumok egymással tökéletes átfedettségben csússzanak egymásba, meg kell tartanuk integritásukat, térbeli szerkezetüket. Érthető tehát, hogy az előző alfejezetben tárgyalt szerkezeti fehérjék (Z-vonal és M-régió fehérjéi, citoszkeletális fehérjék) milyen fontos szerepet játszanak a kontrakció során.
2.4.6. Kontraktilis és elasztikus izomrészek kölcsönhatása: a háromelemes modell
Amikor korábban a teljes izom szerkezetét tárgyaltuk, az izom rugalmasságáért (elaszticitásért) és mechanikai védelméért felelős kollagén kötőszövetet passzív, magukat az erőkifejtésért felelős myofibrillumokat pedig aktív izomrésznek tekintettük. Egy másik elnevezés szerint, melyet az izom mechanikai működésének modellezésénél használunk, az izom úgynevezett elasztikus (elastic muscle elements) és kontraktilis (contractilie muscle elements) elemeket tartalmaz. Az aktin és miozin fehérjéket az izom kontraktilis elemeinek tekintjük, ezek kapcsolata hozza létre a kontrakciót. Az izom elasztikus elemei a kontraktilis elemekkel vagy sorba, vagy párhuzamosan kapcsolódnak. A vázizom kontraktilis és elasztikus alkotóelemeinek a működését, egymással való kölcsönhatását a 2.10. ábrán látható háromelemes izommodellel szoktuk jellemezni (Hill, 1938).
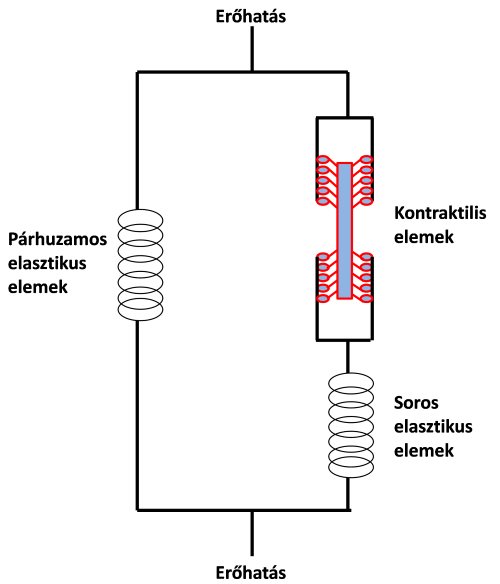
2.10. ábra. A vázizom mechanikai működését reprezentáló háromelemes modell Hill (1938) alapján. A kontraktilis elemek az aktív erőkifejtésért felelnek. A soros elasztikus elemek a kontraktilis elemek erejét közvetítik a teherre (pl. inak a csontokra). A párhuzamos elasztikus elemek az izom nagy terjedelmű passzív nyújtásakor feszülnek meg, meggátolva a kontraktilis elemek elszakítását.
A modellben a soros elasztikus elemeket (series elastic muscle elements) az inak, valamint a miofilamentumok belső rugalmassága reprezentálja. Ezeknek elsősorban a kontrakció alatt van jelentős szerepük, vagyis amikor az izom aktív állapotban van. Amikor a kontraktilis elemek rövidülnek, a soros elasztikus elemek a legyőzendő ellenállásra közvetítik az erőt. A soros elasztikus elemek rugalmasságnak nagyon fontos szerepe van az olyan mozgásoknál, mint például az ugrás és a futás), ugyanis megnyúlásuk során elasztikus energiát tárolnak (a rugókhoz hasonlóan), és amikor összehúzódnak ez az energia felszabadul, segítve a kontraktilis fehérjék (aktin és miozin kötések) erőkifejtését.
Fontos megértenünk, hogy a nagyméretű, csontokhoz tapadó inakon kívül a mikroszkopikus méretű szarkomeren belül is vannak olyan molekulák, amelyek rendelkeznek elasztikus tulajdonsággal. A kutatók szerint mind az aktin, mind pedig a miozin filamentum jelentős rugalmassággal bírnak. Állatkísérletben igazolták, hogy a miozin farki része akár 2,5-szeresére nyúlhat az eredeti hosszához képest (Schwaiger és mtsai, 2002). Mások szerint kontrakció közben az aktin 40-50%-ot tesz ki a szarkomer nyújthatóságából (Huxley és mtsai, 1994). Ezért soroljuk tehát a miofilamentumok belső rugalmasságát a soros elasztikus elemek közé.
A párhuzamos elasztikus elemeket (parallel elastic muscle elements) az izom fascia, endomysium, perimysium és epimysium részei reprezentálják. Az izom passzív nyújtásában van szerepük. Ha az izmot a normál hosszánál jóval nagyobb mértékben passzívan megnyújtjuk, akkor a nyújtás után ezek az elemek „visszarendezik” az izmot a normál hosszára.
2.4.7. Az izom hossza és keresztmetszete
A fentieket olvasva már bizonyosan egyértelművé vált az olvasó számár, hogy egy izomrost hosszanti irányban fejt ki erőt. A teljes izmok ízületeket hidalnak át és a csontok anatómiai képletein erednek és tapadnak. Az eredés és tapadás közötti „húzóerő” hatására a csontok az ízületi felszíneken elmozdulnak, közelednek egymáshoz és forgás jön létre az ízületi tengelyek körül. A vastus medialis izom például a combcsonton eredve és a sípcsonti érdességen tapadva, áthidalva a térdízületet, a térdízület feszítését (extenzioját) hozza létre. Ugyanakkor egy másik izom, a rectus femoris a térd és csípő ízületet is áthidalja, és mind a térdízület feszítésben, mind pedig a csípőízület hajlításában (flexiojában) szerepet játszik. Bármelyik izmot is tárgyaljuk az emberi szervezetben, nyilvánvaló, hogy különböző feladatok elvégzésre alakultak azok ki. Hosszban, keresztmetszetben, alakban és funkcióban valamennyi különbözik. Az izmok szerkezeti és morfometriai (alaktani) tulajdonságai jelentősen befolyásolják az izmok erőkifejtő képességét és kontrakciós sebességét.
Bár az izomrostok hosszanti irányban fejtenek ki erőt, a rostok elrendeződése különbözhet izmonként, és azok nem mindig futnak párhuzamosan a teljes izom erőkifejtési irányával. Ha a teljes izmot vesszük figyelembe, akkora annak eredésénél és tapadásánál található ínvégződések mutatják, hogy az egész izom valójában milyen irányba fejt ki erőt. Az izmokban található izomrostok lefutása gyakran szöget zár be az ínnal.Az izmok szerkezeti felépítettsége alatt azt értjük, hogy a rostok hogyan rendeződnek el az izom erőkifejtési tengelyéhez képest.
Az izmokat az alábbi morfometriai tulajdonságokkal jellemezhetjük:
- Izomtérfogat
- Izomkeresztmetszet
- Rostkeresztmetszet
- Teljes izom hossza
- Izomrost hossza
- Szarkomer hossza
- Tollazottság szöge
Az izom anatómiai keresztmetszete (anatomical muscle cross-sectional area) alatt az izom hosszúsági tengelyére (az eredést és tapadást összekötő egyenes) merőleges metszés által kapott legnagyobb területet értjük (2.11. ábra). Értékét általában mm2-ben fejezik ki. Az izom-keresztmetszeti területet csak kifinomult eszközökkel lehet meghatározni, mint például a mágneses rezonancia képalkotás (MRI), vagy a computer tomográfia (CT). Sok esetben helytelenül végtagkerületi mérésekkel (pl. comb, felkar) próbálják becsülni az izmok keresztmetszetét, de egy MRI képen azonban látható, hogy a kerületi mérések valójában magába foglalják a bőr, a bőr alatti zsírszövet, az epimysium, a csontszövet és a csontvelő területét is, tehát e becslések pontatlanok. Az MRI által készített képekből kihagyhatók ezek a passzív szövetek a számolásból. Továbbá az sem mindegy, hogy az izom teljes hosszának tekintetében melyik szegmens területét vizsgáljuk. MRI segítségével az izom teljes hosszában bizonyos távolságban (pl. 1 cm) keresztmetszeti képeket (szeletek) készíthetünk. A szeletekben megmérhetjük az izmok, izomfejek keresztmetszeti területét. Ismerve a szeletek vastagságát (pl. 1 cm) és a keresztmetszetet, kiszámolható egy szelet térfogata. Az összes szelet térfogatának összege fogja adni az izom térfogatát.
Az izom anatómiai keresztmetszetének mérésének funkcionális szempontból kevés értelme van. Inkább olyan longitudinális vizsgálatoknál van jelentősége, ahol az izom keresztmetszetét/térfogatát határozzák meg valamilyen edzésprogram előtt és után, hogy kiderítsék az edzés izomnövelő hatását (Váczi és mtsai 2014). Az öregedő, vagy a disztrofiás (örökletes betegség miatt sorvadó) izom térfogatának változása is jól nyomon követhető anatómiai keresztmetszet-mérésekkel.
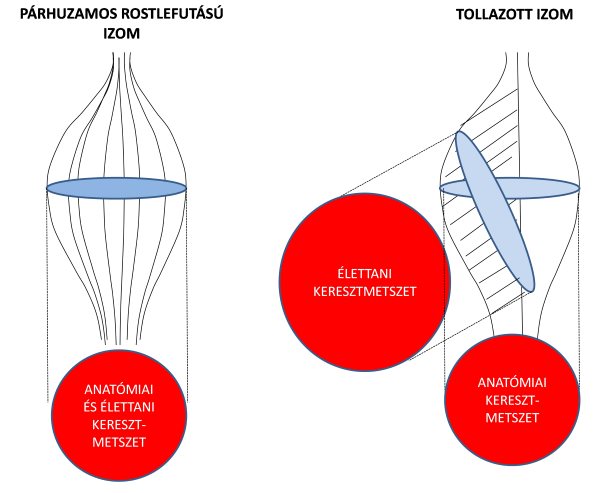
2.11. ábra. Párhuzamos rostlefutású (bal) és tollazott izom (jobb) anatómiai és élettani keresztmetszetének összehasonlítása.
A fentiekben már említettük, hogy az izomrostok erőkifejtésének iránya sokszor nem esik egy vonalba a teljes izom húzóerejének irányával, hanem azzal szöget zár be. Ezt a jelenséget az izom tollazottságának (pennation) nevezzük. Az ín és a hozzá tapadó izomrostok által bezárt szög alapján szerkezetileg kétféle izmot különítünk el. Az egyik az párhuzamos rostlefutású izom (pl. orsó, szíj, vagy pánt alakú) izom (2.11. ábra), amelyben az rostok közel párhuzamosan futnak az izom erőkifejtési tengelyével, vagyis nem zárnak be szöget. Az ínakhoz közeli rostok egyetlen ponton az ínba olvadnak bele, és oda közvetítik az erőt. A másik típus a tollazott izom (2.11. ábra), amelyben a rostok mindegyike az ín teljes hosszán, annak különböző pontjain tapad. A rostok szorosan egymás mellett helyezkednek el és szöget zárnak be az izom inával. A rostok erőkifejtésének iránya nem esik egybe az ín tengelyével, ezért a rostok által kifejtett erőnek csak egy része tevődik át az ínra. Ez az érték a háromszögre alkalmazott szögfüggvény segítségével határozható meg, azaz
Fín = Fizomrost · cos ɵ
ahol Fín az ín által kifejtett erő, Fizomrost az izomrost által kifejtett erő, ɵ pedig a rost és az ín által bezárt szög (2.12. ábra).
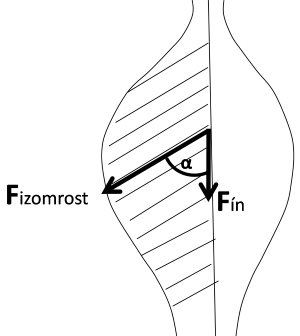
2.12. ábra. Az izomrost és az ín erőkifejtési iránya a tollazott izomban.
A képletből adódóan nagyobb tollazottsági szög esetén kisebb lesz az izomrost által az ínra átvitt erő. Ha a tollazott elrendeződés miatt a különálló rostok erőkifejtési iránya kedvezőtlen, mert eltér a teljes izom erőkifejtési tengelyétől, akkor vajon milyen előnyünk származhat az ilyen izmokból? Gans és Bock (1965) vetették fel annak ötletét, hogy az izom keresztmetszetét ne az anatómiai síkokban, hanem a rostok lefutására merőlegesen mérjék. Ezzel az eljárással az izom élettani keresztmetszetét (physiological cross-sectional area) határozták meg (2.11. ábra). A 2.11. ábrán szemléltetett orsó alakú és tollazott izom anatómiai keresztmetszete azonos. Míg az orsó alakú izomhoz tartozó anatómiai és élettani keresztmetszet megegyezik, a tollazott izom élettani keresztmetszete jóval nagyobb, mint az anatómiai, mert sok egyforma hosszúságú rost egymás mellett helyezkedik el. És nagyobb élettani keresztmetszet nagyobb erőkifejtést eredményez, tehát a tollazott izmok nagy ellenállás leküzdésére alkalmasak, annak ellenére, hogy a különálló rostok erőkifejtési iránya nem egyezik meg az ín tengelyével. A tollazottság főleg az antigravitációs izmokra (pl.: m. vastus medialis, m. gluteus maximus, m. gastrocnemius) jellemző, melyek teherbírásra alkalmasak, a testtartásért és helyzetváltoztatásért felelősek. Ezek általában az extensor izmok.
Vannak olyan izmok, amelyben a különálló rostok nem azonos szöget zárnak be az ínnal, vagyis a tollazottság szöge az ín mentén változik (pl. m. deltoideus). Az ilyen izmokat többszörösen tollazott izomnak nevezzük. A tollazott izmok további érdekessége, hogy rövidülés és nyúlás közben változtatják a rostok a tollazottság szögét, nevezetesen rövidülés közben a szög nő, nyúlás közben pedig csökken. Ennek abban van jelentősége, hogy különböző izomhossznál más és más erőkifejtésre képes az izom, és létezik egy optimális izomhossza, amelynél a legnagyobb erőkifejtésre képes. Végül azt is fontos megjegyeznünk, hogy a tollazott izomban a rostok egységnyi rövidülése nagyobb elmozdulást eredményez az ínban. Ennek pedig abban van jelentősége, hogy az egyébként is rövid rostokat tartalmazó tollazott izmok ne veszítsenek jelentősen rövidülési sebességükből. Ennek részletes magyarázatával az alábbiakban foglalkozunk.
Vajon milyen funkcióval rendelkeznek a párhuzamos rostlefutású izmok? Mint ahogyan korábban említettük, ezekben az izmokban a rostok teljesen, vagy megközelítőleg párhuzamosan futnak a közös ínnal, vagyis a rostok erejük közel 100%-át adják át az ínnak. Míg a legnagyobb tollazottsági szöggel rendelkező izmok például a m. soleus (25°), a m. biceps femoris rövid feje (23°), vagy a m. gastrocnemius mediális feje (16°), a legkisebb szög például a m. sartoriusban (0°), a m. biceps femoris hosszú fejében (0°), vagy a m. semitendinosusban (5°) figyelhető meg (Wickiewich és mtsai 1983). Az párhuzamos rostlefutású izmok, melyek általában a flexor izmok, a tollazotthoz képest hosszabbak is, és hosszabb izomrostokat is tartalmaznak. A hosszabb izomrostokban több szarkomer kapcsolódik sorban egymáshoz, ami nagyobb rövidülési sebességet jelent. Képzeljük el, hogy ha minden szarkomerben egyszerre közelednek egymáshoz a Z vonalak, akkor a teljes izom rövidülési sebessége attól függ, hogy hány szarkomer van sorba kapcsolva. A párhuzamos rostlefutású izmok közül a m. sartorius a leghosszabb, akár 50 cm hosszúságú is lehet, és akár 45 cm hosszú izomrostot is tartalmazhat. Ezzel szemben a m. vastus medialis 33 cm hosszú, és csupán 7 cm-es rostokból áll (Wickiewich és mtsai 1983). Világos, hogy a párhuzamos rostlefutású izmok előnye a magas rövidülési sebesség, melynek a testet védő reflexmechanizmusában van jelentősége. Ha valaki például véletlenül belelép egy rajzszögbe, a fájdalomérző receptorokon keresztül egy reflexszerű izomösszehúzódás következik be az alsó végtag flexor izmaiban (pl.: m. tibialis anterior, m. iliopsoas, m. biceps femoris), melyek hirtelen felrántják a végtagot a sérülés minimalizálása érdekében.
Az emberi vázizmok szerkezetének változatossága lenyűgöző. Hosszban és tollazottság szögében valamennyi különbözik, ezért vagyunk képesek oly sokféle feladat elvégzésére és az erőkifejtés pontos szabályozására. Látható, hogy a normális életvitelben a tollazott és a párhuzamos rostlefutású izom eltérő funkcióval bír, attól függően, hogy teherbírásra, vagy esetleg a testet védő reflexkontrakcióra van-e szükség. Felmerül a kérdés, hogy sportmozgásoknál milyen szerepet töltenek be ezek az izmok. A vázizmok szerkezetének ismerete mindenképpen fontos azoknak a szakembereknek, akik az emberi izomerő fokozásával foglalkoznak. Ismerniük kell azt a tényt, hogy a vékonyabb, gyorsabb izmok pl. kevésbé reagálnak a keresztmetszet-növelő edzésekre, mivel kevés rostot tartalmaznak. Ugyanakkor erősítésükkel jelentősen növelhető a mozgás gyorsasága (pl. sprintfutás). A tollazott izmok kedvezőbben reagálnak a keresztmetszet-növelő edzésekre, viszont érdekes jelenség, hogy ha a rostok keresztmetszete nő, akkor azok egymás férőhelyét akarják elfoglalni, és így megnő a tollazottság szöge. Bár a nagyobb tollazottsági szög csökkenti az ínra közvetített erőt, a keresztmetszet-nökedés mégis erőgyarapodáshoz vezet ezekben az izmokban.
ÖSSZEFOGLALÁS
- A vázizmok aktív kontraktilis és passzív kötőszöveti részekből állnak.
- A vázizom funkcionális egysége a szarkomer, amelyben a vastag (miozin) és vékony (aktin) filamentumok egymással párhuzamos elcsúszása okozza az izom rövidülését és nyúlását. Ezt csúszófilamentum mechanizmusnak nevezzük.
- Kontrakció során a szarkomer szerkezeti fehérjéi tartják meg a miofilamentumok és a miofibrillumok egységét, integritását.
- A soros elasztikus elemek szerepe az erőt közvetítésében van kontrakciós során.
- A párhuzamos elasztikus elemek az izom nagymértékű passzív nyújtásakor tanúsítanak ellenállást, és a nyújtás befejezésével az izmot visszarendezi az eredeti hosszára.
- Az élettani keresztmetszet arányos az izom erőkifejtő képességével, és a rostokra merőlegesen állapítjuk meg.
- A tollazott izom nagy teherbírásra alkalmas, mert nagy az élettani keresztmetszete.
- Az orsó alakú izom nagy sebességű összehúzódásra alkalmas, mert hosszú rostokat tartalmaz.
- Hosszabb izomrost gyorsabban rövidül, mert több szarkomer kapcsolódik egymás után sorba.
Irodalomjegyzék
Edmonson DG, Olson EN (1989) A gene with homology to the myc similarity region of myoD is expressed during myogenesis and is sufficient to activate the muscle differentiation program. Genes Development, 3, 628-640.
Buller AJ, Eccles JC, Eccles RM (1960) Interactions between motorneurons and muscles in respect to the characteristic speed of their responses. Journal of Physiology (London), 150, 417-439.
Erickson HP (1997) Stretching single protein molecules: Titin is a weird spring. Science, 276, 1090-1092.
Hill AV (1938) "The heat of shortening and dynamics constants of muscles". Proc. R. Soc. Lond. B (London: Royal Society) 126, 136–195.
Huxley AF, Niedergerke R (1954) Srtuctural changes in muscle during contraction. Interference microscopy of living muscle fibers. Nature, 173, 971-973.
Huxley HE, Hanson J (1954) Changes in the cross-striations of muscle during contraction and stretch, and their structural interpretation. Nature, 173, 973-976.
Huxley HE, Stewart A, Sosa H, Irving T (1994) X-ray diffraction measurements of the extensibility of actin and myosin filaments in contracting muscle. Biophysical Journal, 67, 2411-2421.
Keller TCS (1997) Molecular bungees. Nature, 387, 233-235.
Monaco AP, Neve RL, Colletti-Feener C, Bertelson CJ, Kurnit DM, Kunkel LM (1986) "Isolation of candidate cDNAs for portions of the Duchenne muscular dystrophy gene". Nature, 323, 646–650.
Ounjian M, Roy RR, Elderd E, Garfunkel A, Payne JR, Armstrong A, Toga AW, Edgerton VR (1991) Physiological and developmental implications of motor unit anatomy. Journal of Neurobiology, 22, 547-559.
Poo MM (1982) Rapid lateral diffusion of functional Ach receptors in embryonic muscle cell membrane. Nature, 295, 333-334.
Rayment I, Holden HM, Whittaker M, Yohn CB, Lorenz M, Holmes KC, Milligan RA (1993) Structure of the actin-myosin complex and its implications for muscle contraction. Science, 261, 58-65.
Scales JB, Olson EN, Perry M (1990) Two distinct Xenopus genes with homology to MyoD1 are expressed before somite formation in early embryogenesis. Molecular and Cellular Biology, 10, 1516-1524.
Schwaiger I, Sattler C, Hostetter DR, Rief M (2002) The myosin coiled-coil is a truly elastic protein structure. Nature Materials, 1, 232-235.
Thompson WJ, Sutton LA, Riley DA (1984) Fibre type composition of single motor units during synapse elimination in neonatal rat soleus muscle. Nature, 309, 709-711.
Vaczi M, Nagy SA, Koszegi T, Ambrus M, Bogner P, Perlaki G, Orsi G, Toth K, Hortobagyi T (2014) Mechanical, hormonal, and hypertrophic adaptations to 10weeks of eccentric and stretch-shortening cycle exercise training in old males. Experimental Gerontology, 58, 69-77.
Wickiewich TL, Roy RR, Powell PL, Edgerton VR (1983) Muscle architecture of the human lower linb. Clin Orthop Rel Res, 179, 275-283.
| « Előző fejezet | Tartalomjegyzék | Következő fejezet » |
Események
Jelenleg nincs aktuális esemény.

















